Потенциальная теория Поланьи
Теория потенциала Полани , также называемая теорией адсорбционного потенциала Полани, представляет собой модель адсорбции, предложенную Майклом Полани , в которой адсорбция может быть измерена через равновесие между химическим потенциалом газа вблизи поверхности и химическим потенциалом газа на большом расстоянии. В этой модели он предположил, что притяжение, в значительной степени обусловленное силами Ван-дер-Ваальса газа к поверхности, определяется положением частицы газа относительно поверхности, и что газ ведет себя как идеальный газ до конденсации , когда газ превышает свое равновесное давление паров . В то время как теория адсорбции Генри более применима при низком давлении, а уравнение изотермы адсорбции БЭТ более полезно при значениях от 0,05 до 0,35 P/Po, теория потенциала Полани имеет гораздо большее применение при более высоких значениях P/Po (~0,1–0,8).
Обзор
Майкл Полани
Михаэль Полани, FRS (11 марта 1891 г. – 22 февраля 1976 г.) был венгерским энциклопедистом , который внес теоретический вклад в физическую химию, экономику и философию. Полани был известным химиком-теоретиком, который внес вклад в область химии через три основных направления исследований: адсорбция газов на твердых телах, рентгеноструктурный анализ свойств твердых тел и скорость химических реакций. Однако Полани был активен как в теоретических, так и в экспериментальных исследованиях в области химии. Полани получил степень по медицине в 1913 году, а также степень доктора философии по физической химии в 1917 году в Будапештском университете . Позже в своей жизни он преподавал в качестве профессора химии в Институте кайзера Вильгельма в Берлине, а также в Манчестерском университете в Манчестере, Англия .
История
Предложенная теория
В 1914 году Полани написал свою первую работу по адсорбции, в которой предложил модель адсорбции газа на твердой поверхности. [1] После этого в 1916 году он опубликовал полностью разработанную работу, которая включала экспериментальную проверку его студентов и других авторов. Во время его исследований в Будапештском университете его наставник, профессор Георг Бредиг, отправил результаты своих исследований Альберту Эйнштейну . Эйнштейн ответил Бредигу, заявив:
Статьи вашего М. Полани мне очень понравились. Я проверил в них самое главное и нашел их в основе своей правильными.
Позже Полани описал это событие следующим образом:
Бац! Я был ученым.
Полани и Эйнштейн продолжали периодически переписываться в течение следующих 20 лет.
Критика
Модель адсорбции Полани подвергалась сильной критике в течение нескольких десятилетий после публикации. Его упрощенная модель для определения адсорбции была сформирована во время открытия фиксированных диполей Дебая , атомной модели Бора , а также развивающейся теории межмолекулярных сил и электростатических сил ключевыми фигурами в мире химии, включая WH Bragg , WL Bragg и Willem Hendrik Keesom . Противники его модели утверждали, что теория Полани не учитывает эти новые теории. Критика включала то, что модель не учитывает электрические взаимодействия газа и поверхности, и что присутствие других молекул будет экранировать притяжение газа к поверхности. Модель Полани была подвергнута дальнейшему изучению после экспериментальных заявлений Ирвинга Ленгмюра с 1916 по 1918 год, благодаря исследованиям которого он в конечном итоге получил Нобелевскую премию в 1932 году. Однако Полани не смог принять участие во многих из этих обсуждений, поскольку он служил офицером-медиком в австро-венгерской армии на сербском фронте во время Первой мировой войны . Полани писал об этом опыте так:
Я сам был некоторое время защищен от любых сведений об этих событиях, поскольку служил офицером-медиком в австро-венгерской армии с августа 1914 по октябрь 1918 года, а также из-за последующих революций и контрреволюций, которые продолжались до конца 1919 года. Члены менее информированных кругов в других местах некоторое время продолжали находиться под впечатлением простоты моей теории и ее обширных экспериментальных подтверждений. [1]
Оборона
Полани описал, что «поворотный момент» принятия его модели адсорбции произошел, когда Фриц Габер попросил его полностью защитить свою теорию в Институте физической химии кайзера Вильгельма в Берлине, Германия . На этой встрече присутствовали многие ключевые фигуры в научном мире, включая Альберта Эйнштейна. Выслушав полное объяснение Полани своей модели, Габер и Эйнштейн заявили, что Полани «продемонстрировал полное пренебрежение к научно установленной структуре вещества». Годы спустя Полани описал свое испытание, заключив:
В профессиональном плане я едва выжил в этой ситуации.
Полани продолжал предоставлять подтверждающие доказательства, подтверждающие обоснованность его модели, спустя годы после этой встречи. [1]
Опровержение
«Освобождение» Полани (как он это описал) от этих отвержений и критики его модели произошло в 1930 году, когда Фриц Лондон предложил новую теорию сил сцепления, основанную на теориях квантовой механики о поляризации электронных систем. Полани написал в Лондон с просьбой:
«Подвержены ли эти силы экранированию мешающими молекулами? Будет ли твердое тело, действующее под действием этих сил, обладать пространственно фиксированным адсорбционным потенциалом?»
После компьютерного анализа была сделана совместная публикация Полани и Лондона, в которой утверждалось, что адсорбционные силы ведут себя аналогично модели, предложенной Полани. [1]
Дальнейшие исследования
Теория Полани имеет историческое значение, и ее работа была использована в качестве основы для других моделей, таких как теория объемного заполнения микропор (TVFM) и теория Дубинина–Радушкевича. Другие исследования были выполнены в свободной форме с использованием потенциальной теории Полани, например, явление капиллярной конденсации, открытое Зигмонди. В отличие от теории Пойлани, которая включает плоскую поверхность, исследования Зигмонди включают пористую структуру, такую как кремниевые материалы. Его исследования доказали, что конденсация паров может происходить в узких порах ниже стандартного давления насыщенного пара . [2]
Теория
Теория потенциальной адсорбции Полани

Теория потенциальной адсорбции Полани основана на предположении, что молекулы вблизи поверхности движутся в соответствии с потенциалом, подобным потенциалу гравитации или электрических полей. [3] Эта модель применима в случае газов на поверхности при постоянной температуре. Молекулы газа движутся ближе к этой поверхности, когда давление выше равновесного давления пара. Изменение потенциала относительно расстояния от поверхности можно рассчитать с помощью формулы для разности химического потенциала,
где - химический потенциал , - молярная энтропия , - молярный объем , - молярная внутренняя энергия .
При равновесии химический потенциал газа на расстоянии от поверхности, , равен химическому потенциалу газа на бесконечно большом расстоянии от поверхности, . В результате интегрирование от бесконечно большого расстояния до расстояния r от поверхности приводит к
где — парциальное давление на расстоянии r , а — парциальное давление на бесконечном расстоянии от поверхности.
Поскольку температура остается постоянной, разницу в формуле химического потенциала можно проинтегрировать по давлениям и
Установив , уравнение можно упростить до
Используя закон идеального газа , получаем следующую формулу
Поскольку газ конденсируется в жидкость на поверхности, когда давление газа превышает равновесное давление пара, , можно предположить, что на поверхности образуется жидкая пленка толщиной, . Энергия при равна
Учитывая, что парциальное давление газов связано с концентрацией, адсорбционный потенциал можно рассчитать как
где — насыщенная концентрация адсорбата, — равновесная концентрация адсорбата.
Теории, основанные на теории адсорбции Полани
Теория потенциала претерпела множество уточнений и изменений на протяжении многих лет с момента ее первого доклада. Одной из основных теорий, которая была разработана с использованием теории Полани, были теории Дубинина, уравнения Дубинина–Радушкивича и Дубинина–Астахова.
Используя адсорбционный потенциал, степень заполнения адсорбционного пространства можно рассчитать как
где - значение адсорбции при температуре T и равновесном давлении p , - максимальное значение адсорбции, - характеристическая энергия адсорбции в кДж/моль, - потеря свободной энергии Гиббса при адсорбции, равная и - подгоночный коэффициент. [4] Уравнение Дубинина-Радушкивича, где равно 2, и оптимизированное уравнение Дубинина-Астахова, где - подгонка под экспериментальные данные, можно упростить до
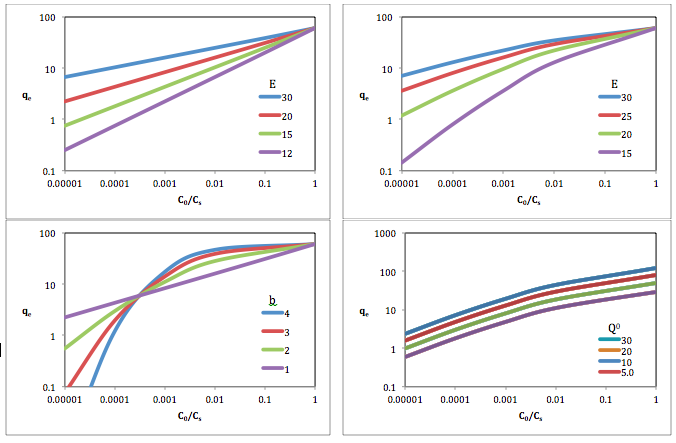
Вверху слева: Q 0 = 60; b = 1
Вверху справа: Q 0 = 60; b = 1,5
Внизу слева: Q 0 = 60; E = 20
Внизу справа: E = 20; b = 1,5
В других исследованиях использовался Дубинин-Астахов в похожей форме ,
где — равновесная адсорбированная концентрация адсорбента в мг/г, — максимальная адсорбированная концентрация адсорбента в мг/г, — эффективный адсорбционный потенциал, где равен , — равновесная концентрация адсорбента в фазе раствора в мг/л, — растворимость адсорбента в воде в мг/л. [5]
Характеристическую энергию адсорбции можно связать с характеристической энергией адсорбции для стандартного пара на той же поверхности, с помощью коэффициента сродства,
Коэффициент сродства — это отношение свойств образца и стандартных паров.
где и — поляризуемости образца и стандартных паров соответственно. Было проведено много исследований для определения оптимальных коэффициентов подгонки, , и коэффициентов сродства, , для наилучшего описания адсорбции газов и паров на твердых телах. В результате уравнение Дубинина–Астахова остается в использовании в исследованиях адсорбции из-за точности, которую оно может получить при подгонке под экспериментальные результаты.
Параметры Дубинина–Астахова для паров и газов
| Сложный | Активированный уголь | , кДж/моль | Источник | ||
|---|---|---|---|---|---|
| Бензол | Углеродное молекулярное сито | 1.78 | 11.52 | 1.00 | [6] |
| Ацетон | Углеродное молекулярное сито | 2.00 | 9.774 | 0,85 | [6] |
| Бензол | КАЛ АС | 2 | 18.23 | 1.00 | [7] |
| Ацетон | КАЛ АС | 2 | 13.21 | 0,72 | [7] |
| Ацетон | Углеродное молекулярное сито | 2.8 | 20.29 | 0,72 | [8] |
| Бензол | Углеродное молекулярное сито | 3.1 | 28.87 | 1.00 | [8] |
| Азот | Углеродное молекулярное сито | 2.6 | 11.72 | 0,41 | [8] |
| Кислород | Углеродное молекулярное сито | 2.3 | 9.21 | 0,32 | [8] |
| Водород | Углеродное молекулярное сито | 2.5 | 5.44 | 0,19 | [8] |
Приложение
Во многих современных исследованиях теория Полани широко используется при изучении активированных углей или сажи. Теория успешно применялась для моделирования различных сценариев, таких как адсорбция газа на активированном угле и процесс адсорбции неионных полициклических ароматических углеводородов . [9] Позднее эксперименты также показали, что она может моделировать ионные полициклические ароматические углеводороды, такие как фенолы и анилины . Совсем недавно изотерма адсорбции Полани использовалась для моделирования адсорбции углеродных наночастиц .
Характеристика углеродных наночастиц
Исторически теория использовалась для моделирования неоднородных адсорбатов и многокомпонентных растворенных веществ. Для определенных пар адсорбатов и адсорбентов математические параметры теории Полиани могут быть связаны с физико-химическими свойствами как адсорбентов, так и адсорбатов. Теория использовалась для моделирования адсорбции углеродных нанотрубок и углеродных наночастиц. В исследовании, проведенном Янгом и Сином [5] , было показано, что теория лучше соответствует изотерме адсорбции, чем Ленгмюр , Фрейндлих и разделение. Эксперимент изучал адсорбцию органических молекул на углеродных наночастицах и углеродных нанотрубках. Согласно теории Полиани, кривизна дефектов поверхности углеродных наночастиц может влиять на их адсорбцию. Плоские поверхности на частицах позволят большему количеству поверхностных атомов приблизиться к адсорбирующим органическим молекулам, что увеличит потенциал, что приведет к более сильным взаимодействиям. Теория оказалась полезной в попытке понять механизмы адсорбции органических соединений на углеродных наночастицах и оценить адсорбционную емкость и сродство. Используя эту теорию, исследователи надеются создать углеродные наночастицы для конкретных нужд, например, для использования их в качестве сорбентов в исследованиях окружающей среды.
Адсорбция из разных систем
В одном из более ранних исследований, проведенных Manes, M., & Hofer, LJE, [10], теория Полиани использовалась для характеристики изотерм адсорбции жидкой фазы на активированном угле различных концентраций с использованием широкого спектра органических растворителей. Было показано, что теория Полиани хорошо подходит для этих различных систем. Благодаря результатам исследование представило возможность прогнозирования изотерм для аналогичных систем с использованием минимальных данных. Однако ограничение заключается в том, что изотермы адсорбции для большого количества растворителей могут соответствовать только ограниченному диапазону. Кривая не смогла соответствовать данным в диапазоне высокой емкости. Исследование также пришло к выводу, что в результатах было несколько аномалий. Адсорбция из четыреххлористого углерода , циклогексана и сероуглерода на активированном угле не смогла хорошо соответствовать кривой и остается невыясненной. Исследователи, проводившие эксперимент, предполагают, что стерические эффекты четыреххлористого углерода и циклогексана могли сыграть свою роль. Исследование проводилось с использованием различных систем, таких как органические жидкости из водных растворов и органические твердые вещества из водных растворов.
Конкурентная адсорбция
Поскольку были исследованы различные системы, было проведено исследование для изучения индивидуальной адсорбции смешанного раствора. Это явление также называется конкурентной адсорбцией, поскольку растворенные вещества имеют тенденцию конкурировать за одни и те же места адсорбции. В эксперименте, проведенном Розеном и Манесом, [11] конкурентная адсорбция глюкозы , мочевины , бензойной кислоты , фталида и п-нитрофенола . Используя модель адсорбции Полани, они смогли рассчитать относительную адсорбцию каждого соединения на поверхности активированного угля.
Смотрите также
Ссылки
- ^ abcd Полани, М (1963). "Потенциальная теория адсорбции". Science . 141 (3585): 1010– 013. Bibcode :1963Sci...141.1010P. doi :10.1126/science.141.3585.1010. PMID 17739484.
- ^ Дабровски, А. (2001). «Адсорбция от теории к практике» (PDF) . Достижения в области коллоидной и интерфейсной науки . 93 ( 1–3 ): 135–224 . doi :10.1016/S0001-8686(00)00082-8. PMID 11591108.
- ^ Батт, Ханс-Юрген; Граф, Карлхайнц; Каппль, Майкл (2003). Физика и химия интерфейсов . стр. 193–195 . doi : 10.1002/3527602313. ISBN 978-3-527-40413-1.
- ^ Дубинин, М.М.; Астахов, ВА (1971). «Развитие представлений об объемном заполнении микропор при адсорбции газов и паров микропористыми адсорбентами». Известия АН СССР, Отделение химических наук . 20 (1): 3–7 . doi :10.1007/bf00849307.
- ^ ab Yang, K.; Xing, B. (2010). «Адсорбция органических соединений углеродными наноматериалами в водной фазе: теория Полани и ее применение». Chemical Reviews . 110 (10): 5989– 6008. doi :10.1021/cr100059s. PMID 20518459.
- ^ ab Doong, SJ; Yang, RT (1988). «Простая модель теории потенциала для прогнозирования адсорбции смешанного газа». Industrial & Engineering Chemistry Research . 27 (4): 630– 635. doi :10.1021/ie00076a017.
- ^ ab Tamon, H.; Okazaki, M. (1996). «Влияние кислотных поверхностных оксидов активированного угля на характеристики адсорбции газа». Carbon . 34 (6): 741– 746. doi :10.1016/0008-6223(96)00029-2.
- ^ abcde Кавазое, К.; Каваи, Т.; Эгучи, Й.; Итога, К. (1974). «Корреляция данных по адсорбционному равновесию различных газов и паров на молекулярно-ситовом углероде». Журнал химической инженерии Японии . 7 (3): 158– 162. doi : 10.1252/jcej.7.158 .
- ^ Yang, K.; Wu, W.; Jing, Q & Zhu, L. (2008). «Водная адсорбция анилина, фенола и их заменителей многослойными углеродными нанотрубками». Environmental Science and Technology . 42 (21): 7931– 6. Bibcode : 2008EnST...42.7931Y. doi : 10.1021/es801463v. PMID 19031883.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Манес, М.; Хофер, Б. Дж. Э. (1969). «Применение теории адсорбционного потенциала Полани к адсорбции из раствора на активированном угле». Журнал физической химии . 73 (3): 584– 590. doi :10.1021/j100723a018.
- ^ Манес, М. Р.; Манес, М. (1976). «Применение теории адсорбционного потенциала Полани к адсорбции из раствора на активированном угле. VII. Конкурентная адсорбция твердых веществ из водного раствора». Журнал физической химии . 80 (9): 953–959 . doi :10.1021/j100550a007.













































