Перекись калия
 | |
| Имена | |
|---|---|
| Название ИЮПАК Перекись калия | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.037.339 |
| Номер ЕС |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| К2О2 | |
| Молярная масса | 110,196 г/моль |
| Появление | желтое аморфное твердое вещество |
| Температура плавления | 490 °C (914 °F; 763 К) |
| реагирует с водой [1] | |
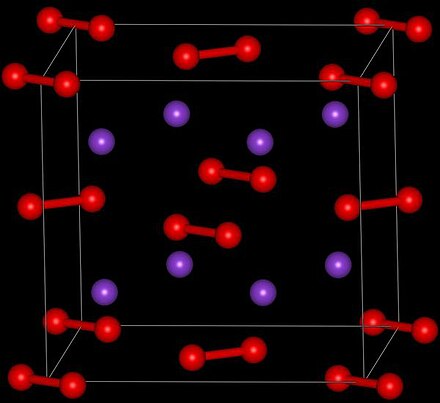
| Структура | |
| Орторомбический | |
| Cmca, oS16 | |
| Термохимия | |
Стандартная молярная энтропия ( S ⦵ 298 ) | 113 Дж·моль −1 ·К −1 [2] |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −496 кДж·моль −1 [2] |
| Опасности | |
| Маркировка СГС : | |
  | |
| Опасность | |
| Н272 , Н315 , Н319 | |
| P210 , P220 , P221 , P264 , P280 , P302+P352 , P305+P351+P338 , P321 , P332+P313 , P337+P313 , P362 , P370+P378 , P501 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы | Хлорид калия |
Другие катионы | Пероксид лития Пероксид натрия Пероксид рубидия Пероксид цезия |
| Оксид калия Супероксид калия Озонид калия | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Пероксид калия — неорганическое соединение с молекулярной формулой K2O2 . Он образуется при реакции калия с кислородом воздуха, а также оксидом калия (K2O ) и надпероксидом калия (KO2 ) .
Перекись калия реагирует с водой с образованием гидроксида калия и кислорода :
- 2 К 2 О 2 + 2 Н 2 О → 4 КОН + О 2 ↑
Характеристики
Перекись калия — это высокореактивное, окисляющее твердое вещество от белого до желтоватого цвета, которое, хотя и не является горючим, бурно реагирует с горючими материалами. Оно бурно разлагается при контакте с водой . [1]
Стандартная энтальпия образования пероксида калия составляет ΔH f 0 = −496 кДж/моль.
Использование
Перекись калия используется в качестве окислителя и отбеливателя (благодаря содержанию перекиси ), а также для очистки воздуха.
Ссылки
- ^ Лид, Дэвид Р. (1998). Справочник по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 477, 520. ISBN 0-8493-0594-2.
- ^ ab Zumdahl, Steven S. (2009). Химические принципы 6-е изд . Houghton Mifflin Company. стр. A22. ISBN 978-0-618-94690-7.



