Полиднавириформиды
| Полиднавирус | |
|---|---|
 | |
| Электронная микрофотография браковируса | |
| Классификация вирусов | |
| (без рейтинга): | Вириформ |
| Семья: | Полиднавириформиды |
| Генера | |
| Синонимы | |
| |
Polydnaviriformidae ( / pɒ ˈ lɪ d nə vɪ rə ˌ fɔː mɪ dɛ / PDV ) [1] — семейство вириформных насекомых ; члены семейства известны как полиднавирусы . В семействе есть два рода: Bracoform и Ichnoviriform . Полиднавирусы образуют симбиотические отношения с паразитоидными осами . Ichnoviriforms ( IV ) встречаются у ос-ихневмонид , а Bracoviriforms (BV) — уос -браконид . Личинки ос обеих этих групп сами паразитируют на чешуекрылых (мотыльках и бабочках), и полиднавирусы играют важную роль в обходе иммунного ответа своих паразитирующих хозяев. [2] [3] Между BV и IV практически нет гомологии последовательностей , что позволяет предположить, что эти два рода развивались независимо друг от друга в течение длительного времени.
Таксономия
Браковириформный
- Браковириформный альтитудинис
- Браковириформный аргентифронтис
- Браковириформный blackburni
- Браковириформ канадский
- Браковириформные конгрегаты
- Bracoviriform crassicornis
- Браковириформный кроцеипедис
- Bracoviriform curvimaculati
- Браковириформный демолиторис
- Браковириформные ectdytolophae
- Браковириформные фасетозные
- Браковириформный флавикоксис
- Браковириформный флавипедис
- Браковириформные флавитестовые
- Браковириформные дымчатые
- Браковириформные клубочки
- Браковириформные гифантрии
- Браковириформные инаниты
- Браковириформный индийский
- Браковириформный островковый
- Браковириформные карии
- Браковириформный липаридис
- Браковириформный маргинивентрис
- Браковириформные меланосцелы
- Браковириформный нигриципит
- Браковириформный орнигис
- Браковириформные палеокриты
- Браковириформные четырехзубчатые
- Браковириформные рубекулы
- Браковириформные шефери
- Браковириформные тексани
Ихновириформные
- Ихновириформные акроникты
- Ихновириформные кольчатые
- Ихновириформный апрель
- Ихновириформные арджуны
- Ихновириформный бенефакторис
- Ихновириформные эрибори
- Ихновириформные эксигуа
- Ихновириформные флавицинкты
- Ихновириформные форципаты
- Ихновириформные бегонии
- Ихновириформные дымянки
- Ихновириформные коленчатые
- Ихновириформные паразиты
- Ихновириформные прерывания
- Ихновириформные лимантрии
- Ихновириформные монтани
- Ихновириформные волоски
- Ихновириформный соперник
- Ихновириформный ростралис
- Ихновириформный соноренс
- Ихновириформный тенуифеморис
- Ихновириформные теребрантисы
Структура
Вирусы в Polydnaviridae имеют оболочку , с вытянутой эллипсоидной и цилиндрической геометрией. Геномы кольцевые и сегментированные, состоят из нескольких сегментов двухцепочечной, суперспиральной ДНК , упакованной в капсидные белки . Их длина составляет около 2,0–31 кб. [2]
| Род | Структура | Симметрия | Капсид | Геномное расположение | Геномная сегментация |
|---|---|---|---|---|---|
| Ихновириформные | Вытянутый эллипсоид | Обернутый | Круговой | Сегментированный | |
| Браковириформный | Вытянутый эллипсоид | Обернутый | Круговой | Сегментированный |
Жизненный цикл
Репликация вируса ядерная. Методом транскрипции является транскрипция с использованием шаблона ДНК. Вирус покидает клетку-хозяина путем экспорта через ядерную пору .
Хозяевами вируса служат паразитоидные осы, а хозяевами этих ос служат чешуекрылые. Самка осы впрыскивает в своего хозяина одно или несколько яиц вместе с некоторым количеством вируса. Вирус и оса находятся в мутуалистических симбиотических отношениях: экспрессия вирусных генов не позволяет иммунной системе хозяина осы убить введенное яйцо осы и вызывает другие физиологические изменения, которые в конечном итоге приводят к смерти паразитированного хозяина. Пути передачи являются родительскими. [2]
| Род | Подробности о хозяине | Тканевой тропизм | Подробности записи | Подробности релиза | Место репликации | Место сборки | Передача инфекции |
|---|---|---|---|---|---|---|---|
| Ихновириформные | Паразитоидные осы (Ichneumonidae) | Гемоциты; жировые тела | Неизвестный | Почкование через клеточную мембрану [2] [4] | Ядро | Ядро | Неизвестный |
| Браковириформный | Паразитоидные осы (Braconidae) | Гемоциты; жировые тела | Неизвестный | Лизис [2] | Ядро | Ядро | Неизвестный |
Биология
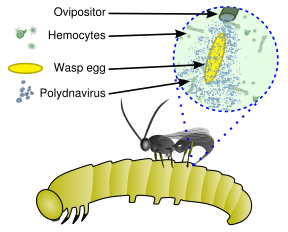
Эти вирусы являются частью уникальной биологической системы, состоящей из эндопаразитической осы ( паразитоида ), личинки-хозяина (обычно чешуекрылых ) и вируса. Полный геном вируса является эндогенным , распределенным по геному осы. Вирус реплицируется только в определенной части яичника, называемой чашечкой , куколки и взрослой самки осы. Вирус вводится вместе с яйцом осы в полость тела гусеницы-хозяина чешуекрылых и заражает клетки гусеницы. Инфекция не приводит к репликации новых вирусов; скорее, она влияет на иммунную систему гусеницы , поскольку вирион несет гены вирулентности вместо генов вирусной репликации. [5] Его можно считать типом вирусного вектора . [6]
Без вирусной инфекции фагоцитарные гемоциты (клетки крови) инкапсулируют и убивают яйцо и личинки осы, но подавление иммунитета, вызванное вирусом, позволяет яйцу и личинкам осы выживать, что приводит к вылуплению и полному развитию незрелой осы в гусенице. Кроме того, гены, экспрессируемые из полиднавируса в паразитирующем хозяине, изменяют развитие и метаболизм хозяина, что благоприятно влияет на рост и выживание личинки паразитоида. [4] [7]
Потенциальные подсемейства носителей
- Ихневмоноидеи
- Бракониды
- Микрогастрины [4] [8]
- Мирацины
- Cheloninae [4]
- Кардиохилины [4]
- Mendeselinae
- Койхоинае
- Ихневмониды
- Кампоплегины [4]
- Банхины [4] [6]
- Бракониды
Характеристики
Оба рода PDV имеют определенные общие характеристики:
- вирусные частицы каждого из них содержат несколько сегментов dsDNA (двуцепочечной, или «нормальной» ДНК, в отличие от одноцепочечной ДНК или РНК с положительным или отрицательным зарядом, которые встречаются у некоторых других вирусов), причем каждый сегмент содержит только часть полного генома (подобно хромосомам в эукариотических организмах )
- геном вируса имеет эукариотические характеристики, такие как наличие интронов (обычно для генов насекомых, но редко для вирусов) и низкая плотность кодирования [9]
- геном каждого вируса интегрирован в геном хозяина-осы [10]
- геном организован в несколько многочленных семейств генов (которые различаются у браковирусов и ихновирусов)
- вирусные частицы вырабатываются только в определенных типах клеток в репродуктивных органах самок ос
Морфология двух родов различается при наблюдении с помощью электронного микроскопа. Ихновирусы, как правило, яйцевидные, тогда как браковирусы — короткие палочки. Вирионы браковирусов высвобождаются путем лизиса клеток ; вирионы ихновирусов высвобождаются путем почкования.
Эволюция
Анализ нуклеиновых кислот предполагает очень длительную связь вирусов с осами (приблизительно 73,7 миллиона лет ± 10 миллионов). [11]
Старая теория, основанная на осах
Было выдвинуто два предложения о том, как развивалась ассоциация оса/вирус. Первое предполагает, что вирус произошел от генов осы. Многие паразитоиды, которые не используют PDV, вводят белки, которые обеспечивают многие из тех же функций, то есть подавление иммунного ответа на яйцо паразита. В этой модели осы-бракониды и ихневмониды упаковали гены для этих функций в вирусы, по сути, создав систему переноса генов, которая приводит к тому, что гусеница вырабатывает иммуносупрессивные факторы. В этом сценарии структурные белки PDV (капсиды), вероятно, были «заимствованы» у существующих вирусов. [12]
Современная теория эндогенного вируса
Альтернативное предложение предполагает, что предковые осы развили полезную ассоциацию с существующим вирусом, что в конечном итоге привело к интеграции вируса в геном осы. После интеграции гены, ответственные за репликацию вируса и капсиды (в конечном итоге) больше не были включены в геном PDV. Эта гипотеза подтверждается явными различиями в морфологии между IV и BV, что предполагает разные предковые вирусы для двух родов. BV, вероятно, произошел от нудивируса , в частности от бетанудивируса, [13] ~ 100 миллионов лет назад . [14] IV имеет менее ясное происхождение: хотя более ранние отчеты обнаружили белок p44/p53 со структурным сходством с асковирусом , эта связь не была подтверждена в более поздних исследованиях. [15] В результате, в настоящее время считается, что IV произошел от еще не идентифицированного нового вирусного семейства, [13] имеющего слабую связь с NCLDV . [16] В любом случае оба рода были сформированы в результате одного интеграционного события в соответствующих линиях ос. [5]
Две группы вирусов в этом семействе фактически не связаны филогенетически, что предполагает, что этот таксон может нуждаться в пересмотре. [17]
Влияние на иммунитет хозяина
У хозяина могут быть запущены несколько механизмов иммунной системы насекомых, когда оса откладывает яйца и когда развивается паразитическая оса. Когда в тело насекомого вводится крупное тело (яйцо осы или небольшая частица, используемая в эксперименте), классической иммунной реакцией является инкапсуляция гематоцитами. Инкапсулированное тело также может быть меланизировано с целью его удушения благодаря другому типу гемоцитов, который использует путь фенолоксидазы для выработки меланина. Мелкие частицы могут быть фагоцитированы, а макрофагальные клетки затем также могут быть меланизированы в узелке. Наконец, насекомые также могут отвечать выработкой противовирусных пептидов . [18]
ПолиДНКвирус защищает личинок перепончатокрылых от иммунной системы хозяина, действуя на разных уровнях.
- Во-первых, они могут отключать или уничтожать гематоциты. ПолиДНК-вирус, связанный с Cotesia rubecula , кодирует белок CrV1, который денатурирует актиновые филаменты в гематоцитах, поэтому эти клетки становятся менее способными двигаться и прилипать к личинкам. [18] Браковирус Microplitis demolitor (MdBV) вызывает апоптоз гематоцитов благодаря своему гену PTP-H2. [18] Он также снижает адгезионную способность гематоцитов благодаря своему гену Glc1.8. Этот ген также подавляет фагоцитоз. [19]
- ПолиДНКвирус также может влиять на меланизацию, MdBV препятствует выработке фенолоксидазы . [20]
- Наконец, полиДНК-вирус может также продуцировать вирусные анкирины , которые мешают выработке противовирусных пептидов. [21] У некоторых ихновирусов ванкирин также может предотвращать апоптоз, экстремальную реакцию клетки, чтобы блокировать распространение вируса. [22] [23]
- Ихновирусы производят некоторые белки, называемые виннексины, которые были признаны гомологичными иннексинам насекомых . Они отвечают за кодирование структурных единиц щелевых контактов. Эти белки могут изменять межклеточную коммуникацию, что может объяснить нарушение процесса инкапсуляции . [24]
Вирусоподобные частицы
Другая стратегия, используемая паразитоидными перепончатокрылыми для защиты своего потомства, — это производство вирусоподобных частиц . VLP похожи на вирусы по своей структуре, но они не несут никакой нуклеиновой кислоты. Например, Venturia canescens ( Ichneumonidea ) и Leptopilina sp. ( Figitidaea ) производят VLP.
VLP можно сравнить с полиДНК-вирусом, поскольку они секретируются одинаково, и оба действуют для защиты личинок от иммунной системы хозяина. V. canescens -VLP (VcVLP1, VcVLP2, VcNEP ...) производятся в клетках чашечки, прежде чем они попадут в яйцеводы. Работа 2006 года не обнаружила их связи с какими-либо вирусами и предположила клеточное происхождение. [12] Более позднее сравнение связывает их с сильно перетасованными одомашненными последовательностями нудивируса . Эта связь дает название Venturia canescens эндогенный нудивирус (VcENV), альфанудивирус, тесно связанный с NlENV, обнаруженным в Nilaparvata lugens . [25]
VLP защищают личинки перепончатокрылых локально, тогда как полиДНК-вирус может иметь более глобальный эффект. VLP позволяют личинкам избегать иммунной системы: личинка не распознается как вредоносная для своего хозяина, или иммунные клетки не могут взаимодействовать с ней благодаря VLP. [12] Venturia canescens использует их вместо полиДНК-вирусов, потому что ее ихновирус дезактивирован. [25]
Оса Leptopilina heterotoma секретирует VLP, которые способны проникать в ламелоциты благодаря специфическим рецепторам, а затем изменять форму и поверхностные свойства ламелоцитов, так что они становятся неэффективными, а личинки защищены от инкапсуляции. [26] VLP Leptopilina или внеклеточные везикулы смешанной стратегии (MSEV) содержат некоторые системы секреции. Их эволюционная картина менее ясна, [27] но недавно описанный вирус, L. boulardi Filamentous Virus (LbFV), показывает значительное сходство. [28]
Микро-РНК
МикроРНК — это небольшие фрагменты РНК, которые производятся в клетках-хозяевах благодаря специфическому ферментативному механизму. Они способствуют разрушению вирусной РНК. МикроРНК прикрепляются к вирусной РНК, поскольку они комплементарны. Затем комплекс распознается ферментом, который его разрушает. Это явление известно как PTGS (от post transcriptional gene silencing) [29] или RNAi ( РНК-интерференция ).
Интересно рассмотреть явление микроРНК в контексте полиДНКвируса. Можно сформулировать множество гипотез:
- Бракониды несут в своем геноме гены, связанные с нудивирусом [30], поэтому они могут быть способны вырабатывать микроРНК против нудивируса в качестве врожденного иммунитета.
- Осы, возможно, используют микроРНК для контроля вирусных генов, которые они переносят.
- ПолиДНКвирус также может использовать PTGS для вмешательства в экспрессию генов хозяина.
- PTGS также используется для развития организмов, используя те же ферменты, что и для подавления антивирусных генов, поэтому мы можем предположить, что если хозяин использует PTGS против полиДНК-вируса, возможно, это также влияет на его развитие.
Смотрите также
Ссылки
- ^ "Подробности таксона: Polydnaviriformidae". ictv.global .
Предложение: 2021.006DRPolydnaviriformidae_1renfam_3rensp
- ^ abcde "Viral Zone". ExPASy . Получено 15 июня 2015 г. .
- ^ "Virus Taxonomy: 2020 Release". Международный комитет по таксономии вирусов (ICTV). Март 2021 г. Получено 24 мая 2021 г.
- ^ abcdefg Вебб, BA (1998). Полиднавирусная биология, структура генома и эволюция . В Miller, LK, Ball, LA, Eds. Вирусы насекомых . Plenum Publishing Corporation. стр. 105–139.
- ^ ab Strand, MR; Burke, GR (май 2015 г.). «Полиднавирусы: от открытия до современных идей». Вирусология . 479–480: 393–402. doi : 10.1016/j.virol.2015.01.018 . PMC 4424053. PMID 25670535 .
- ^ ab Burke, Gaelen R.; Strand, Michael R. (31 января 2012 г.). «Полиднавирусы паразитических ос: одомашнивание вирусов для использования в качестве векторов доставки генов». Насекомые . 3 (1): 91–119. doi : 10.3390/insects3010091 . PMC 4553618. PMID 26467950 .
- ^ Руссинк, М. Дж. (2011). «Изменения в популяционной динамике мутуалистических и патогенных вирусов». Вирусы . 3 (1): 12–19. doi : 10.3390/v3010012 . PMC 3187592. PMID 21994724 .
- ^ Мерфи, Николас; Бэнкс, Джонатан К.; Уитфилд, Джеймс Б.; Остин, Эндрю Д. (1 апреля 2008 г.). «Филогения паразитических подсемейств микрогастроидов (Hymenoptera: Braconidae) на основе данных о последовательностях семи генов с улучшенной оценкой времени происхождения линии». Молекулярная филогенетика и эволюция . 47 (1): 378–395. doi :10.1016/j.ympev.2008.01.022. PMID 18325792.
- ^ Webb, BA; Strand, MR; Dickey, SE; Beck, MH; Hilgarth, RS; Barney, WE; Kadash, K.; Kroemer, JA; Lindstrom, KG; Rattanadechakul, W.; Shelby, KS; Thoetkiattikul, H.; Turnbull, MW; Witherell, RA; et al. (2006). «Геномы полиднавирусов отражают их двойную роль как мутуалистов и патогенов». Вирусология . 347 (1): 160–174. doi : 10.1016/j.virol.2005.11.010 . PMID 16380146.
- ^ Флеминг, Дж.-АГВ и Саммерс, МД (1991). «ДНК полиднавируса интегрирована в ДНК его хозяина-паразитоидной осы». Труды Национальной академии наук . 88 (21): 9770–9774. Bibcode : 1991PNAS...88.9770F. doi : 10.1073/pnas.88.21.9770 . PMC 52802. PMID 1946402 .
- ^ Уитфилд, Дж. Б. (2002). «Оценка возраста симбиоза полиднавируса и осы-бракониды». Труды Национальной академии наук . 99 (11): 7508–7513. Bibcode : 2002PNAS...99.7508W. doi : 10.1073 /pnas.112067199 . PMC 124262. PMID 12032313.
- ^ abc Аннет Рейнеке; Сассан Асгари и Отто Шмидт (2006). «Эволюционное происхождение вирусоподобных частиц Venturia canescens». Архивы биохимии и физиологии насекомых . 61 (3): 123–133. doi :10.1002/arch.20113. PMID 16482583.
- ^ ab Дрезен, Дж. М.; Леобольд, М.; Безье, А.; Хьюге, Э.; Волкофф, А. Н.; Херниу, Е. А. (август 2017 г.). «Эндогенные вирусы паразитических ос: вариации на общую тему». Current Opinion in Virology . 25 : 41–48. doi : 10.1016/j.coviro.2017.07.002. PMID 28728099.
- ^ Эрниу Э.А., Уге Э., Тезе Дж., Безье А., Перике Г., Дрезен Ж.М. (2013). «Когда осы-паразиты захватили вирусы: геномная и функциональная эволюция полиднавирусов». Philos Trans R Soc Lond B Biol Sci . 368 (1626): 20130051. doi :10.1098/rstb.2013.0051. ПМЦ 3758193 . ПМИД 23938758.
- ^ Volkoff, AN; Jouan, V; Urbach, S; Samain, S; Bergoin, M; Wincker, P; Demettre, E; Cousserans, F; Provost, B; Coulibaly, F; Legeai, F; Béliveau, C; Cusson, M; Gyapay, G; Drezen, JM (27 мая 2010 г.). «Анализ структурных компонентов вириона выявляет остатки генома предкового ихновируса». PLOS Pathogens . 6 (5): e1000923. doi : 10.1371/journal.ppat.1000923 . PMC 2877734. PMID 20523890 .
- ^ Беливо, К; Коэн, А; Стюарт, Д; Перике, Ж; Джумад, А; Кун, Л; Штольц, Д; Бойл, Б; Волков А.Н.; Эрниу, Э.А.; Дрезен, Дж. М.; Кассон, М. (сентябрь 2015 г.). «Геномный и протеомный анализ показывает, что полиднавирусы банчина и кампоплегина имеют схожих, если не идентичных, вирусных предков». Журнал вирусологии . 89 (17): 8909–21. дои : 10.1128/JVI.01001-15 . ПМК 4524098 . ПМИД 26085165.
- ^ Dupuy C, Huguet E, Drezen JM (2006). «Развертывание эволюционной истории полиднавирусов». Virus Res . 117 (1): 81–89. doi :10.1016/j.virusres.2006.01.001. PMID 16460826.
- ^ abc JM. Drezen; S. Savary; M. Poirier; G. Periquet (1999). «Полиднавирусы, вирусные сущности, одомашненные паразитоидными осами». Virologie . 3 (1): 11–21.
- ^ Маркус Бек и Майкл Р. Стрэнд (февраль 2005 г.). «Glc1.8 из Microplitis demolitor Bracovirus вызывает потерю адгезии и фагоцитоза в клетках насекомых High Five и S2». Журнал вирусологии . 79 (3): 1861–1870. doi :10.1128/jvi.79.3.1861-1870.2005. PMC 544146. PMID 15650210 .
- ^ Лу Чжицян; Бек Маркус Х.; Ван Ян; Цзян Хаобо; Стрэнд Майкл Р. (август 2008 г.). «Вирусный белок Egf1.0 — ингибитор двойной активности профенолоксидазо-активирующих протеиназ 1 и 3 из Manduca sexta». Журнал биологической химии . 283 (31): 21325–21333. doi : 10.1074/jbc.M801593200 . PMC 2490783. PMID 18519564 .
- ^ Bae Sungwoo; Kim Yonggyun (1 сентября 2009 г.). «Гены IkB, закодированные в Cotesia plutellae bracovirus, подавляют противовирусный ответ и усиливают патогенность бакуловируса против капустной моли Plutella xylostella». Journal of Invertebrate Pathology . 102 (1): 79–87. doi :10.1016/j.jip.2009.06.007. ISSN 0022-2011. PMID 19559708.
- ^ Fath-Goodin A.; Kroemer JA; Webb B. A (август 2009 г.). «Белок ванкирина P-vank-1 вируса Campoletis sonorensis ингибирует апоптоз в клетках насекомых Sf9». Insect Molecular Biology . 18 (4): 497–506. doi :10.1111/j.1365-2583.2009.00892.x. PMID 19453763. S2CID 31146050.
- ^ Clavijo G, Dorémus T, Ravallec M, Mannucci MA, Jouan V, Volkoff AN, Darboux I (2011). "Мультигенные семейства в Ichnovirus: исследование специфичности тканей и хозяев посредством анализа экспрессии ванкиринов из Hyposoter didymator Ichnovirus". PLOS ONE . 6 (11): e27522. Bibcode : 2011PLoSO...627522C. doi : 10.1371/journal.pone.0027522 . PMC 3210807. PMID 22087334 .
- ^ Марциано НК; Хасэгава Д.К.; Фелан П.; Тернбулл М.В. (октябрь 2011 г.). «Функциональные взаимодействия между полиднавирусом и клеточными иннексинами хозяина». Журнал вирусологии . 85 (19): 10222–9. дои : 10.1128/jvi.00691-11. ПМК 3196458 . ПМИД 21813607.
- ^ ab Leobold, Matthieu; Bézier, Annie; Pichon, Apolline; Herniou, Elisabeth A; Volkoff, Anne-Nathalie; Drezen, Jean-Michel; Abergel, Chantal (июль 2018 г.). «Одомашнивание крупного ДНК-вируса осой Venturia canescens подразумевает целенаправленное сокращение генома посредством псевдогенизации». Genome Biology and Evolution . 10 (7): 1745–1764. doi : 10.1093/gbe/evy127 . PMC 6054256. PMID 29931159 .
- ^ RM Rizki; TM Rizki (ноябрь 1990 г.). «Паразитоидные вирусоподобные частицы разрушают клеточный иммунитет дрозофилы». Труды Национальной академии наук Соединенных Штатов Америки . 87 (21): 8388–8392. Bibcode : 1990PNAS...87.8388R. doi : 10.1073/pnas.87.21.8388 . PMC 54961. PMID 2122461 .
- ^ Хевнер, ME; Рамруп, J; Геген, G; Рамраттан, G; Долиос, G; Скарпати, M; Квиат, J; Бхаттачарья, S; Ван, R; Сингх, S; Говинд, S (25 сентября 2017 г.). «Новые органеллы с элементами бактериальных и эукариотических систем секреции превращают паразитов дрозофилы в оружие». Current Biology . 27 (18): 2869–2877.e6. doi : 10.1016/j.cub.2017.08.019 . PMC 5659752 . PMID 28889977.
- ^ Ди Джованни, Д; Лепети, Д; Гине, Б; Беннетот, Б; Булестей, М; Куте, Ю; Буше, О; Раваллек, М; Варальди, Дж. (1 октября 2020 г.). «Родственник вируса, манипулирующего поведением, как источник адаптивных генов для паразитоидов дрозофилы». Молекулярная биология и эволюция . 37 (10): 2791–2807. bioRxiv 10.1101/342758 . дои : 10.1093/molbev/msaa030 . ПМИД 32080746.
- ^ Ли, Х. В. и Дин, С. В. (2005). «Антивирусное подавление у животных». FEBS Lett . 579 (26): 5965–5973. doi : 10.1016/j.febslet.2005.08.034. PMC 1350842. PMID 16154568 .
- ^ Безье А, Аннахайм М, Эрбиньер Дж, Веттервальд С, Гьяпай Г, Бернар-Самен С, Винкер П, Родити I, Хеллер М, Белгази М, Пфистер-Вильгельм Р, Перике Г, Дюпюи С, Юге Э, Волков А.Н., Ланцрейн Б., Дрезен Дж. М. (13 февраля 2009 г.). «Полиднавирусы ос-браконид происходят от предкового нудивируса». Наука . 13. 323 (5916): 926–30. Бибкод : 2009Sci...323..926B. дои : 10.1126/science.1166788. PMID 19213916. S2CID 6538583.
- ICTVdB Management (2006). 00.055. Полиднавирусы. В: ICTVdB — Универсальная база данных вирусов, версия 4. Бюхен-Осмонд, К. (ред.), Колумбийский университет, Нью-Йорк, США
- Espagne, E.; et al. (2004). «Последовательность генома полиднавируса: взгляд на эволюцию симбиотических вирусов». Science . 306 (5694): 286–289. Bibcode :2004Sci...306..286E. doi :10.1126/science.1103066. PMID 15472078. S2CID 12260572.
Внешние ссылки
- http://research.biology.arizona.edu/mosquito/willott/507/polydnaviruses.html
- Вирусная зона: Полиднавирусы
- ИКТВ