Орто-эффект
Ортоэффект — это явление органической химии , при котором присутствие химической группы в орто-положении или в положениях 1 и 2 фенильного кольца относительно карбоксильного соединения изменяет химические свойства соединения. Это вызвано стерическими эффектами и связывающими взаимодействиями наряду с полярными эффектами, вызванными различными заместителями, которые находятся в данной молекуле, что приводит к изменению ее химических и физических свойств. Ортоэффект связан с замещенными бензольными соединениями.
В замещенных бензольных соединениях наблюдаются три основных ортоэффекта:
- Силы стерических препятствий вызывают замещение химической группы в орто-положении бензойных кислот, в результате чего они становятся более сильными кислотами.
- Стерическое ингибирование протонирования, вызванное заменой анилинов на более слабые основания по сравнению с заменой изомеров в мета- и пара-положении.
- Электрофильное ароматическое замещение дизамещенных бензольных соединений вызывает стерические эффекты, которые определяют региоселективность входящего электрофила в дизамещенных бензольных соединениях.
Ортозамещенные бензойные кислоты
Когда замещающая группа находится в орто-положении к карбоксильной группе в замещенном соединении бензойной кислоты, соединение становится более кислотным, превосходя немодифицированную бензойную кислоту.
Обычно орто-замещенные бензойные кислоты являются более сильными кислотами, чем их мета- и пара-изомеры.
Механизм действия
Когда в бензойной кислоте происходит орто-замещение, стерические препятствия заставляют карбоксильную группу выкручиваться из плоскости бензольного кольца. Скручивание подавляет резонанс карбоксильной группы с фенильным кольцом, что приводит к повышению кислотности карбоксильной группы. Эта повышенная кислотность контрастирует с пониженной кислотностью, вызванной дестабилизирующим перекрестным сопряжением. Дестабилизирующее перекрестное сопряжение вызывает пониженную кислотность бензойной кислоты по сравнению с муравьиной кислотой. [1] [2]
значения pKa
В таблице ниже приведены значения pKa различных монозамещенных бензойных кислот.
| Заместитель | Позиция на ринге | ||
|---|---|---|---|
| Орто | Мета | Пара | |
| ЧАС | 4.2 | 4.2 | |
| Гл 3 | 3.9 | 4.3 | 4.4 |
| Ф | 3.3 | 4.3 | 4.4 |
| Кл | 2.9 | 3.8 | 4.0 |
| Бр | 2.8 | 3.8 | 4.0 |
| я | 2.9 | 3.9 | 4.0 |
| ОМе | 4.1 | 4.1 | 4.5 |
| НЕТ 2 | 2.2 | 3.5 | 3.4 |
| ОЙ | 2.98 | 4.08 | 4.58 |
[1]
Ортозамещенный анилин
Когда любая группа присутствует в орто-положении к амидной группе (NH 2 ) в анилине , то основной характер этого соединения становится слабее. Например, см. порядок основности следующих замещенных анилин:-
- п-толуидин > м-толуидин > анилин > о-толуидин
- Анилин > м-Нитроанилин > п-Нитроанилин > о-Нитроанилин
- Анилин > п-Галоанилин > м-Галоанилин > о-Галоанилин
- п-Аминофенол pKb=8,50 > о-Аминофенол pKb=9,28 > Анилин pKb=9,38 > м-Аминофенол pKb=9,80
Протонирование замещенного анилина ингибируется стерическими препятствиями. При протонировании азот в аминогруппе меняет свою орбитальную гибридизацию с sp2 на sp3 , становясь непланарным. Это приводит к стерическим препятствиям между орто-замещенной группой и атомом водорода аминогруппы, что снижает стабильность сопряженной кислоты и, следовательно, снижает pH замещенного анилина.
Электрофильное ароматическое замещение дизамещенных бензольных соединений
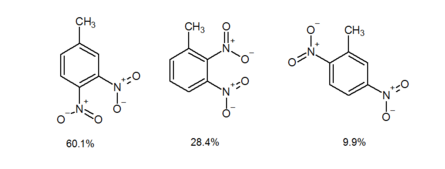
Орто-эффект также возникает, когда мета-направляющая группа располагается в мета-расположении относительно орто-пара-направляющей группы, новый заместитель, введенный в молекулу, имеет тенденцию предпочтительно занимать орто-положение относительно мета-направляющей группы, а не пара-положение. В настоящее время нет окончательного объяснения орто-эффекта, но предполагается, что может быть внутримолекулярная помощь от мета-направляющей группы, влияющая на позиционирование входящего заместителя. [3] Например, электрофильное ароматическое нитрование 1-метил-3-нитробензола дает 4-метил-1,2-динитробензол и 1-метил-2,3-динитробензол с выходами 60,1% и 28,4% соответственно. [4] Напротив, 2-метил-1,4-динитробензол (2c) выделяется с выходом всего 9,9%. [4] Как видно из приведенного выше примера, когда π-акцепторный заместитель (πAS) находится в мета-положении по отношению к π-донорному заместителю (πDS), электрофильное ароматическое нитрование происходит в орто-положении по отношению к πAS, а не в пара-положении.

Похожие результаты были также получены при нитровании 3-метилбензойной кислоты, в которой 5-метил-2-нитробензойная кислота и 3-метил-2-нитробензойная кислота были получены в качестве основных соединений, тогда как 3-метил-4-нитробензойная кислота была зарегистрирована как второстепенное соединение. [5] Также при нитровании нитрования 3-бромбензойной кислоты 5-бром-2-нитробензойная кислота (выход 83%) была получена в качестве основного продукта, а 3-бром-2-нитробензойная кислота (выход 13%) — как второстепенное. Интересно отметить, что потенциальный изомер 3-бром-4-нитробензойная кислота не был обнаружен. [6]
Реакции Дильса-Альдера
Орто-эффект возникает в реакциях Дильса-Альдера , когда Z-замещенные диенофилы реагируют с 1-замещенными бутадиенами с образованием 3,4-дизамещенных циклогексенов, независимо от природы диеновых заместителей. [7]
Ссылки
- ^ ab "Дополнительные темы". www2.chemistry.msu.edu . Получено 2019-03-09 .
- ^ Coetzee, JF; Cunningham, GP (1965). «Водородная связь и орто-эффект в ацетонитриле. Реакция орто-замещенных бензойных кислот с аминами». Журнал Американского химического общества . 87 (12): 2534–2539 . Bibcode : 1965JAChS..87.2534C. doi : 10.1021/ja01090a002. ISSN 0002-7863.
- ^ Лин, Шу-кун; Марч, Джерри (2001-12-31). "March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th Edition". Molecules . 6 (12): 1064– 1065. doi : 10.3390/61201064 . ISSN 1420-3049. PMC 6236433 .
- ^ ab Li, Hui-Jing; Wu, Yan-Chao; Dai, Jian-Hong; Song, b Yan; Cheng, Runjiao; Qiao, Yuanyuan (2014). ""Орто-эффект" в электрофильных ароматических нитрациях: теоретический анализ и экспериментальная проверка". Журнал Китайского химического общества . 61 (12): 1307– 1312. doi :10.1002/jccs.201400092. ISSN 2192-6549.
- ^ Оксли, Джимми К.; Смит, Джеймс Л.; Моран, Джесси С.; Канино, Джонатан Н.; Альмог, Джозеф (июль 2008 г.). «Ароматическое нитрование с использованием нитрогуанидина и ЭГДН». Tetrahedron Letters . 49 (28): 4449– 4451. doi :10.1016/j.tetlet.2008.04.153. ISSN 0040-4039.
- ^ Холмс, Эрик Лейтон; Флюршайм, Бернхард (1928-01-01). "LXI.—Законы ароматического замещения. Часть VI. Количественный метод быстрого определения изомерных нитропроизводных латерально замещенных толуолов". Журнал химического общества (резюме) : 448– 453. doi :10.1039/JR9280000448. ISSN 0368-1769.
- ^ Смит, Майкл (2011). Органический синтез (Третье изд.). Бостон: Academic Press. ISBN 978-0-12-415884-9. OCLC 787844634.
Внешние ссылки
- Дополнительные темы § Ортоэффект – Химический факультет, Мичиганский государственный университет