Орнитиндекарбоксилаза
| Орнитиндекарбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Димер орнитиндекарбоксилазы, Человек | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.1.1.17 | ||||||||
| Номер CAS | 9024-60-6 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| орнитиндекарбоксилаза | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | ОДК1 | ||||||
| ген NCBI | 4953 | ||||||
| HGNC | 8109 | ||||||
| ОМИМ | 165640 | ||||||
| РефСек | NM_002539 | ||||||
| UniProt | Р11926 | ||||||
| Другие данные | |||||||
| Номер ЕС | 4.1.1.17 | ||||||
| Локус | Хр. 2 стр. 25 | ||||||
| |||||||
Фермент орнитиндекарбоксилаза ( EC 4.1.1.17, ODC) катализирует декарбоксилирование орнитина (продукта цикла мочевины ) с образованием путресцина . Эта реакция является обязательным этапом в синтезе полиаминов . [1] У людей этот белок состоит из 461 аминокислоты и образует гомодимер . [2]
У людей орнитиндекарбоксилаза (ODC) экспрессируется геном ODC1 . Белок ODC иногда называют «ODC1» в исследованиях, касающихся людей и мышей, но некоторые виды, такие как Drosophila ( dODC2 ), [3], виды растений семейства Solanaceae ( ODC2 ), [4] и молочнокислые бактерии Paucilactobacillus wasatchensis ( odc2 ) [5] , как было показано, имеют второй ген ODC.
Механизм реакции
Лизин 69 на орнитиндекарбоксилазе (ODC) связывает кофактор пиридоксальфосфат с образованием основания Шиффа . [6] Орнитин вытесняет лизин с образованием основания Шиффа, присоединенного к ортонину, которое декарбоксилируется с образованием хиноидного промежуточного продукта. Этот промежуточный продукт перестраивается с образованием основания Шиффа, присоединенного к путресцину , который подвергается атаке лизина с высвобождением продукта путресцина и реформированием связанного с PLP ODC. [7] Это первый и ограничивающий скорость шаг у людей для производства полиаминов , соединений, необходимых для деления клеток .
Спермидинсинтаза затем может катализировать превращение путресцина в спермидин путем присоединения аминопропильного фрагмента. [8] Спермидин является предшественником других полиаминов, таких как спермин и его структурный изомер термоспермин .
Структура
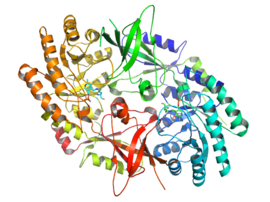
Активная форма орнитиндекарбоксилазы — гомодимер . Каждый мономер содержит домен бочки, состоящий из альфа-бета-бочки , и домен листа, состоящий из двух бета-листов . Домены соединены петлями. Мономеры соединяются друг с другом посредством взаимодействий между бочкой одного мономера и листом другого. Связывание между мономерами относительно слабое, и ODC быстро взаимопревращается между мономерными и димерными формами в клетке. [1]
Пиридоксальфосфатный кофактор связывает лизин 69 на С- конце домена-бочки. Активный сайт находится на границе двух доменов, в полости, образованной петлями обоих мономеров. [ 1]
Функция
Реакция декарбоксилирования орнитина, катализируемая орнитиндекарбоксилазой, является первым и обязательным этапом синтеза полиаминов , в частности путресцина , спермидина и спермина . Полиамины важны для стабилизации структуры ДНК , пути репарации двухцепочечных разрывов ДНК и как антиоксиданты . Таким образом, орнитиндекарбоксилаза является важным ферментом для роста клеток, производя полиамины, необходимые для стабилизации вновь синтезированной ДНК. Недостаток ODC вызывает апоптоз клеток у эмбриональных мышей, вызванный повреждением ДНК. [10]
Протеасомная деградация
ODC является наиболее хорошо охарактеризованным клеточным белком, подверженным убиквитин -независимой протеасомной деградации. Хотя большинство белков должны быть сначала помечены несколькими молекулами убиквитина, прежде чем они будут связаны и деградированы протеасомой , деградация ODC вместо этого опосредована несколькими сайтами распознавания на белке и его дополнительным фактором антизимом . Процесс деградации ODC регулируется в отрицательной обратной связи продуктами его реакции. [11]
До отчета Шеаффа и др. (2000) [12] , в котором было показано, что ингибитор циклинзависимой киназы (Cdk) p21Cip1 также разрушается протеасомой убиквитин-независимым образом, ODC был единственным явным примером убиквитин-независимой протеасомной деградации. [13]
Клиническое значение
ODC является транскрипционной мишенью онкогена Myc [ 14] и активируется при самых разных видах рака. Полиаминные продукты пути, инициированного ODC, связаны с повышенным ростом клеток и сниженным апоптозом . [15] Известно, что ультрафиолетовый свет , [16] асбест [17] и андрогены, выделяемые предстательной железой [18], вызывают повышенную активность ODC, связанную с раком. Было показано, что ингибиторы ODC, такие как эфлорнитин, эффективно снижают рак в животных моделях, [19] и препараты, нацеленные на ODC, тестируются для потенциального клинического использования. Механизм, с помощью которого ODC способствует канцерогенезу , сложен и не полностью изучен. Наряду с их прямым воздействием на стабильность ДНК, полиамины также активируют гены щелевых контактов [20] и подавляют гены плотных контактов . Гены щелевых контактов участвуют в коммуникации между канцерогенными клетками, а гены плотных контактов действуют как супрессоры опухолей. [15]
Было показано, что мутации гена ODC1 вызывают синдром Бахмана-Баппа (BABS), редкое нейрометаболическое расстройство, характеризующееся глобальной задержкой развития, алопецией, макроцефалией, дисморфическими чертами и поведенческими аномалиями. [21] BABS обычно вызывается аутосомно-доминантным вариантом ODC1 de novo . [21]
Экспрессия гена ODC индуцируется большим количеством биологических стимулов, включая судорожную активность в мозге. [22] Инактивация ODC дифторметилорнитином (ДМФО, эфлорнитин ) используется для лечения рака и роста волос на лице у женщин в постменопаузе.
ODC также является ферментом, необходимым для таких паразитов, как Trypanosoma , Giardia и Plasmodium , этот факт используется в препарате эфлорнитин . [23]
Иммунологическое значение
В активированных антигеном Т-клетках ферментативная активность ODC увеличивается после активации, что соответствует увеличению синтеза полиаминов в Т-клетках после активации. [24] Как и в случае с ODC и раком, MYC , также называемый c-Myc для клеточного Myc, является главным регулятором биосинтеза полиаминов в Т-клетках. [25]
Исследование 2020 года, проведенное Ву и соавторами с использованием мышей ODC cKO, специфичных для Т-клеток, показало, что Т-клетки могут нормально функционировать и пролиферировать in vivo , а другие пути синтеза полиаминов могут компенсировать недостаток ODC. [26] Однако блокирование синтеза полиаминов через ODC с помощью DMFO и поглощение полиаминов с помощью AMXT 1501 истощало пул полиаминов, ингибировало пролиферацию Т-клеток и подавляло воспаление Т-клеток. [26]
Недавние исследования показали важность синтеза ODC и полиамина в определении судьбы Т-хелперных клеток . [27] Исследование 2021 года, проведенное Пулстоном и соавторами, показало, что клетки T H 1 и T H 2 экспрессируют более высокие уровни ODC, чем регуляторные клетки T (T reg ) и клетки T H 17 , что соответствует более высоким уровням биосинтеза полиаминов в T H 1 и T H 2. [28] Исследование 2021 года, проведенное Вагнером и соавторами, показало активацию программы Treg у мышей Odc1 -/- . [29] Они пришли к выводу, что экспрессия ферментов, связанных с полиамином, была повышена в патогенных клетках T H 17 и подавлена в клетках Treg. [29]
Ссылки
- ^ abc Kern AD, Oliveira MA, Coffino P, Hackert ML (май 1999). "Структура орнитиндекарбоксилазы млекопитающих при разрешении 1,6 А: стереохимические последствия декарбоксилаз аминокислот, зависящих от PLP". Structure . 7 (5): 567–581. doi : 10.1016/S0969-2126(99)80073-2 . PMID 10378276.
- ^ Pegg AE (май 2006). «Регулирование орнитиндекарбоксилазы». Журнал биологической химии . 281 (21): 14529–14532. doi : 10.1074/jbc.R500031200 . PMID 16459331.
- ^ Ром Э., Кахана К. (1993). «Выделение и характеристика локуса орнитиндекарбоксилазы дрозофилы: доказательства наличия двух транскрибируемых генов ODC в геноме дрозофилы». ДНК и клеточная биология . 12 (6): 499–508. doi :10.1089/dna.1993.12.499. PMID 8329117.
- ^ Qin X, Chetelat RT (май 2021 г.). «Гены орнитиндекарбоксилазы способствуют S-РНКазе-независимому отторжению пыльцы». Физиология растений . 186 (1): 452–468. doi :10.1093/plphys/kiab062. PMC 8154068. PMID 33576789 .
- ^ Berthoud H, Wechsler D, Irmler S (2022-03-03 ) . "Производство путресцина и кадаверина Paucilactobacillus wasatchensis". Frontiers in Microbiology . 13 : 842403. doi : 10.3389/fmicb.2022.842403 . PMC 8928434. PMID 35308356.
- ^ Oliveira EF, Cerqueira NM, Fernandes PA, Ramos MJ (октябрь 2011 г.). «Механизм образования внутреннего альдимина в пиридоксаль-5'-фосфат-зависимых ферментах». Журнал Американского химического общества . 133 (39): 15496–15505. doi :10.1021/ja204229m. PMID 21854048.
- ^ Brooks HB, Phillips MA (декабрь 1997 г.). «Характеристика механизма реакции орнитиндекарбоксилазы Trypanosoma brucei с помощью многоволновой спектроскопии с остановленным потоком». Биохимия . 36 (49): 15147–15155. doi :10.1021/bi971652b. PMID 9398243.
- ^ Тети Д., Висалли М., Макнейр Х. (декабрь 2002 г.). «Анализ полиаминов как маркеров (пато)физиологических состояний». Журнал хроматографии. B, Аналитические технологии в биомедицинских и биологических науках . 781 (1–2): 107–149. doi :10.1016/S1570-0232(02)00669-4. PMID 12450656.
- ^ PDB : 1d7k ; Almrud JJ, Oliveira MA, Kern AD, Grishin NV, Phillips MA, Hackert ML (январь 2000 г.). «Кристаллическая структура человеческой орнитиндекарбоксилазы при разрешении 2,1 А: структурные идеи связывания антизимов». Журнал молекулярной биологии . 295 (1): 7–16. doi :10.1006/jmbi.1999.3331. PMID 10623504.; визуализировано с помощью PyMOL.
- ^ Pendeville H, Carpino N, Marine JC, Takahashi Y, Muller M, Martial JA, Cleveland JL (октябрь 2001 г.). «Ген орнитиндекарбоксилазы необходим для выживания клеток на ранних стадиях развития мышей». Molecular and Cellular Biology . 21 (19): 6549–6558. doi :10.1128/MCB.21.19.6549-6558.2001. PMC 99801 . PMID 11533243.
- ^ Zhang M, Pickart CM, Coffino P (апрель 2003 г.). «Детерминанты распознавания протеасомой орнитиндекарбоксилазы, убиквитин-независимого субстрата». The EMBO Journal . 22 (7): 1488–1496. doi : 10.1093/emboj/cdg158. PMC 152902. PMID 12660156.
- ^ Sheaff RJ, Singer JD, Swanger J, Smitherman M, Roberts JM, Clurman BE (февраль 2000 г.). «Протеасомный оборот p21Cip1 не требует убиквитинирования p21Cip1». Molecular Cell . 5 (2): 403–410. doi : 10.1016/S1097-2765(00)80435-9 . PMID 10882081.
- ^ Verma R, Deshaies RJ (май 2000). «Протеасомный howdunit: случай отсутствующего сигнала». Cell . 101 (4): 341–344. doi : 10.1016/S0092-8674(00)80843-0 . PMID 10830160. S2CID 18425370.
- ^ Bello-Fernandez C, Packham G, Cleveland JL (август 1993 г.). «Ген орнитиндекарбоксилазы является транскрипционной мишенью c-Myc». Труды Национальной академии наук Соединенных Штатов Америки . 90 (16): 7804–7808. Bibcode : 1993PNAS...90.7804B. doi : 10.1073 /pnas.90.16.7804 . PMC 47231. PMID 8356088.
- ^ ab Gerner EW, Meyskens FL (октябрь 2004 г.). «Полиамины и рак: старые молекулы, новое понимание». Nature Reviews. Cancer . 4 (10): 781–792. doi :10.1038/nrc1454. PMID 15510159. S2CID 37647479.
- ^ Ahmad N, Gilliam AC, Katiyar SK, O'Brien TG, Mukhtar H (сентябрь 2001 г.). «Определенная роль орнитиндекарбоксилазы в фотоканцерогенезе». The American Journal of Pathology . 159 (3): 885–892. doi :10.1016/S0002-9440(10)61764-6. PMC 1850478. PMID 11549581 .
- ^ Marsh JP, Mossman BT (январь 1991). «Роль асбеста и активных форм кислорода в активации и экспрессии орнитиндекарбоксилазы в эпителиальных клетках трахеи хомяка». Cancer Research . 51 (1): 167–173. PMID 1846307.
- ^ Crozat A, Palvimo JJ, Julkunen M, Jänne OA (март 1992 г.). «Сравнение андрогенной регуляции экспрессии генов орнитиндекарбоксилазы и S-аденозилметиониндекарбоксилазы в почках грызунов и дополнительных половых органах». Эндокринология . 130 (3): 1131–1144. doi :10.1210/endo.130.3.1537280. PMID 1537280.
- ^ Meyskens FL, Gerner EW (май 1999). «Разработка дифторметилорнитина (DFMO) в качестве химиопрофилактического средства». Clinical Cancer Research . 5 (5): 945–951. PMID 10353725.
- ^ Shore L, McLean P, Gilmour SK, Hodgins MB, Finbow ME (июль 2001 г.). «Полиамины регулируют связь щелевых контактов в клетках, экспрессирующих коннексин 43». The Biochemical Journal . 357 (Pt 2): 489–495. doi :10.1042/0264-6021:3570489. PMC 1221976 . PMID 11439099.
- ^ ab Bupp C, Michael J, VanSickle E, Rajasekaran S, Bachmann AS (1993). «Синдром Бахмана-Баппа». В Adam MP, Mirzaa GM, Pagon RA, Wallace SE (ред.). GeneReviews. Сиэтл (WA): Университет Вашингтона, Сиэтл. PMID 36007106 . Получено 28.06.2023 .
- ^ Herberg LJ, Rose IC, de Belleroche JS, Mintz M (март 1992). «Индукция орнитиндекарбоксилазы и синтез полиаминов при разжигании судорог: эффект альфа-дифторметилорнитина». Epilepsy Research . 11 (1): 3–7. doi :10.1016/0920-1211(92)90015-L. PMID 1563337. S2CID 1221264.
- ^ Хеби О, Перссон Л, Рентала М (август 2007 г.). «Нацеливание на биосинтетические ферменты полиаминов: перспективный подход к терапии африканской сонной болезни, болезни Шагаса и лейшманиоза». Аминокислоты . 33 (2): 359–366. doi :10.1007/s00726-007-0537-9. PMID 17610127. S2CID 26273053.
- ^ Хестерберг RS, Кливленд JL, Эплинг-Бернетт PK (март 2018 г.). «Роль полиаминов в функциях иммунных клеток». Медицинские науки . 6 (1): 22. doi : 10.3390/medsci6010022 . PMC 5872179. PMID 29517999 .
- ^ Miller DM, Thomas SD, Islam A, Muench D, Sedoris K (октябрь 2012 г.). "c-Myc и метаболизм рака". Clinical Cancer Research . 18 (20): 5546–5553. doi :10.1158/1078-0432.CCR-12-0977. PMC 3505847. PMID 23071356 .
- ^ ab Wu R, Chen X, Kang S, Wang T, Gnanaprakasam JR, Yao Y и др. (декабрь 2020 г.). «Синтез de novo и путь спасения координированно регулируют гомеостаз полиаминов и определяют пролиферацию и функцию Т-клеток». Science Advances . 6 (51). Bibcode :2020SciA....6.4275W. doi :10.1126/sciadv.abc4275. PMC 7744078 . PMID 33328226.
- ^ Ши Х, Чи Х (август 2021 г.). «Полиамин: метаболический компас для направления судьбы Т-хелперных клеток». Cell . 184 (16): 4109–4112. doi : 10.1016/j.cell.2021.07.012 . PMID 34358466.
- ^ Puleston DJ, Baixauli F, Sanin DE, Edwards-Hicks J, Villa M, Kabat AM и др. (август 2021 г.). «Метаболизм полиаминов является центральным фактором верности линии Т-хелперов». Cell . 184 (16): 4186–4202.e20. doi :10.1016/j.cell.2021.06.007. PMC 8358979 . PMID 34216540.
- ^ ab Wagner A, Wang C, Fessler J, DeTomaso D, Avila-Pacheco J, Kaminski J, et al. (август 2021 г.). «Метаболическое моделирование отдельных клеток Th17 выявляет регуляторы аутоиммунитета». Cell . 184 (16): 4168–4185.e21. doi :10.1016/j.cell.2021.05.045. PMC 8621950 . PMID 34216539.
Внешние ссылки
- Орнитиндекарбоксилаза на herkules.oulu.fi
- Орнитин+декарбоксилаза в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)

