Оксид никеля гидроксид
 | |
 | |
| Имена | |
|---|---|
| Другие имена Оксигидроксид никеля | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
CID PubChem |
|
| |
| |
| Характеристики | |
| Ni(O)(ОН) | |
| Молярная масса | 91,699 г/моль |
| Появление | черный сплошной |
| Температура плавления | 230 °C (446 °F; 503 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гидроксид никеля — неорганическое соединение с химической формулой NiO(OH). Это черное твердое вещество, нерастворимое во всех растворителях, но разрушаемое основанием и кислотой. Является компонентом никель -металл-гидридной батареи и никель-железной батареи .
Связанные материалы
Оксиды никеля(III) часто плохо охарактеризованы и считаются нестехиометрическими соединениями . Оксид никеля(III) (Ni 2 O 3 ) не был проверен кристаллографически. Для применения в органической химии оксиды или пероксиды никеля производятся in situ и не имеют кристаллографической характеристики. Например, «пероксид никеля» ( CAS# 12035-36-8) также тесно связан или даже идентичен NiO(OH). [1]
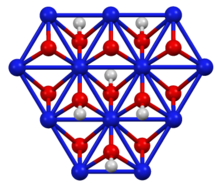
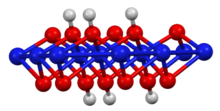
Синтез и структура
Его слоистая структура напоминает структуру брусита полиморфа гидроксида никеля(II) , но с вдвое меньшим количеством атомов водорода. Степень окисления никеля составляет 3+. [2] Его можно получить реакцией гидроксида никеля(II) с водным гидроксидом калия и бромом в качестве окислителя: [3]
- 2 Ni(OH) 2 + 2 KOH + Br 2 → 2 KBr + 2 H 2 O + 2 NiOOH
Использование в органической химии
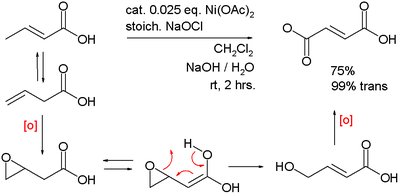
Оксиды никеля (III) катализируют окисление бензилового спирта в бензойную кислоту с использованием отбеливателя: [4]
Аналогично он катализирует двойное окисление 3-бутеновой кислоты в фумаровую кислоту :
Ссылки
- ^ Гэри В. Морроу «Перекись никеля (II)» Энциклопедия реагентов для органического синтеза, 2001 John Wiley & Sons. doi :10.1002/047084289X.rn017
- ^ Касас-Кабанас, М.; Каналес-Васкес, Х.; Родригес Карвахаль, Х.; Паласин, М. Р. «Характеристика материалов для никелевых аккумуляторов: кристаллическая структура бета-(NiOOH)» Труды симпозиума Общества исследователей материалов (2009) 1126, стр. 131–136.
- ^ O. Glemser "β-Nickel(III) Hydroxide" в Handbook of Preparative Inorganic Chemistry, 2nd Ed. Под редакцией G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 1549.
- ^ Эффективная и практичная система для каталитического окисления спиртов, альдегидов и -ненасыщенных карбоновых кислот Джозеф М. Грилл, Джеймс В. Огл и Стивен А. Миллер J. Org. Chem. ; 2006 ; 71(25) стр. 9291 - 9296; (Статья) doi :10.1021/jo0612574