NiFe-гидрогеназа
[NiFe] гидрогеназа — это тип гидрогеназы , окислительного фермента , который обратимо преобразует молекулярный водород в прокариотах , включая бактерии и археи . [1] [2] Каталитический участок фермента обеспечивает простые микроорганизмы, метаболизирующие водород, окислительно-восстановительным механизмом, с помощью которого можно хранить и использовать энергию посредством реакции.
Это особенно важно для анаэробных сульфатредуцирующих бактерий рода Desulfovibrio [3] [4] , а также патогенных организмов Escherichia coli и Helicobacter pylori [2] . Механизмы, созревание и функции гидрогеназ [NiFe] активно исследуются для применения в водородной экономике и в качестве потенциальных мишеней для антибиотиков.
Структура

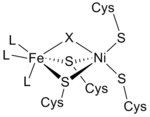
Структура [NiFe] гидрогеназы была получена в результате рентгеновских кристаллографических исследований пяти различных сульфатредуцирующих бактерий: Desulfovibrio vulgaris Miyazaki F, [6] D. gigas , [7] D. frutosovorans , [8] [9] D. desulfuricans, [10] и Desulfomicrobium baculatum . [11] [NiFe] гидрогеназа, выделенная из D. vulgaris Miyazaki F, показана справа. Более крупная субъединица выделена синим цветом, имеет молекулярную массу 62,5 кДа и содержит активный центр Ni-Fe . Меньшая субъединица выделена пурпурным цветом, имеет молекулярную массу 28,8 кДа и содержит кластеры Fe-S .
Из инфракрасных спектров и рентгеновской кристаллографии было обнаружено, что активный центр гидрогеназы [NiFe] представляет собой (S-Cys) 4 Ni(μ-X)Fe(CO)(CN) 2 , в котором общий лиганд X представляет собой либо оксид , серу , гидропероксид , либо гидроксид, находящиеся только в окисленном состоянии. [12] В то время как атом никеля участвует в окислительно-восстановительных реакциях, атом железа постоянно находится в состоянии окисления Fe(II). [12] Точная геометрия трех небелковых лигандов (обозначаемых как L), координирующихся с ионом Fe, неизвестна; однако они были идентифицированы как одна молекула оксида углерода (C≡O) и две молекулы цианида ( − C≡N). [13]
Кластеры Fe-S
Почти все гидрогеназы содержат по крайней мере один кластер железа и серы (кластер Fe-S). Как упоминалось ранее, эти кластеры Fe-S соединяют активный центр фермента никеля с поверхностью белка, поскольку они служат в качестве цепи переноса электронов от окислительно-восстановительного центра Ni-Fe к акцептору электронов цитохрому c 3 (см. семейство цитохромов c ). [13] Эти электроны производятся в результате гетеролитического расщепления молекулы водорода в активном центре Ni-Fe. Кристаллические структуры гидрогеназы показывают Fe 3 S 4 в центре цепи и кластер Fe 4 S 4 на молекулярной поверхности. Расстояние между внутренним кластером Fe 4 S 4 и активным центром составляет приблизительно 12 Å. [13]
Гидрогеназы [NiFe] и [NiFeSe] имеют удивительно схожие структуры, что приводит к предположению, что один атом серы в кластере Fe-S был заменен атомом селена , но эти гидрогеназы различаются по каталитической активности и чувствительности к ингибиторам ферментов . [4]

Ион Mg и протонные пути
[NiFe] гидрогеназа имеет катион Mg2 + , связанный в области C-конца большей субъединицы. Этот катион связан с тремя молекулами воды и тремя аминокислотами , и он стабилизирует эту свободную от растворителя область. На расстоянии примерно 13 Å от фрагмента [NiFe] этот катион соединяет активный сайт с сетью водородных связей и служит в качестве пути переноса протона (H + ). [13]
Газоснабжающий канал
Исследования, в которых ксенон был связан с гидрогеназой, предполагают наличие гидрофобного газового канала, через который газы H 2 , CO и O 2 могли достигать глубоко зарытого активного центра внутри фермента. Кристаллическая структура выявила несколько небольших каналов на поверхности, которые объединились в один более крупный канал, достигший активного центра [Ni-Fe]. [13]
Поскольку хорошо известно, что гидрогеназы чувствительны к кислороду , диффузия газа к активному центру зависит от размера и окружения канала доступа газа, реакции молекулярного кислорода (O 2 ) в активном центре и восстановления активного центра после окисления. [13]
Механизм
Точный механизм реакции гидрогеназ [NiFe] был предметом больших споров. В 2009 году Хигучи и его коллеги предложили механизм, основанный на рентгеновской кристаллографии и спектроскопических данных Desulfovibrio vulgaris Miyazaki F. [13] В ходе каталитического процесса ион Fe в активном центре не меняет своего состояния окисления , в то время как ион металла Ni участвует в окислительно-восстановительной химии. Существует две основные группы окислительно-восстановительных состояний, через которые проходят гидрогеназы [NiFe] во время катализа:
- Неактивные окислительно-восстановительные состояния и
- Активные окислительно-восстановительные состояния.
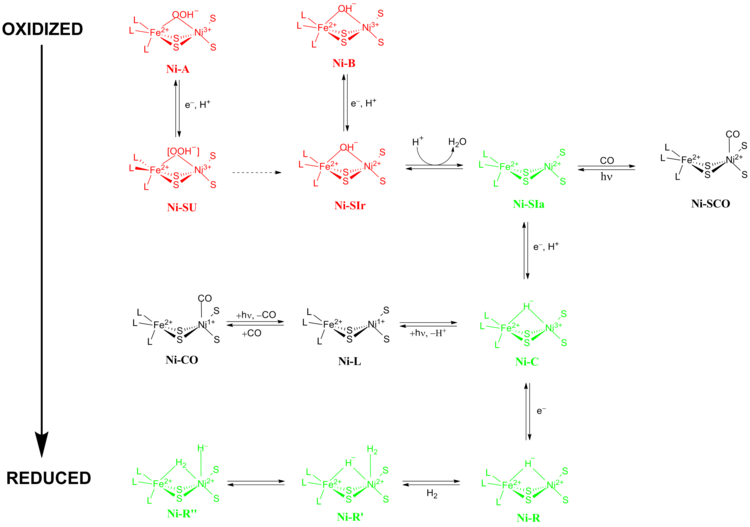
Неактивные окислительно-восстановительные состояния
Ni-A (состояние «неготовности») и Ni-B (состояние «готовности») являются наиболее окисленными формами металлического центра [NiFe] и активируются посредством одноэлектронного восстановления с переносом протона. Скорость восстановительной активации Ni-A в Ni-SU может занять часы, в то время как скорость восстановительной активации Ni-B в Ni-SIr происходит за секунды. [14] Было высказано предположение , что причиной этого несоответствия в кинетике активации между Ni-A и Ni-B является разница в мостиковых лигандах между двумя различными окислительно-восстановительными состояниями. В состоянии Ni-SIr высвобождается молекула воды, образуя состояние Ni-SIa , первое каталитическое окислительно-восстановительное активное состояние гидрогеназ [NiFe].
Активные окислительно-восстановительные состояния
Три наиболее важных каталитических окислительно-восстановительных активных состояния гидрогеназ [NiFe] — это Ni-SIa , Ni-C и Ni-R (которые имеют три различных варианта). [13] Чувствительное к свету состояние Ni-C может быть получено путем одноэлектронного восстановления Ni-SIa . Спектроскопические исследования электронного парамагнитного резонанса состояния Ni-C , которое содержало Ni 3+ с S = 1/2 и гидрид, соединяющий два металла, Ni и Fe, показали, что гетеролитическое расщепление H 2 происходит в активном центре гидрогеназы [NiFe].
Состояния, ингибированные CO
Состояние Ni-SIa может быть ингибировано CO, который напрямую связывается с ионом металла Ni в изогнутой конформации, образуя Ni-SCO (см. ниже). [15] Поскольку Ni-C чувствителен к свету, освещение при 100 К приводит к окислительно-восстановительному состоянию Ni-L . В ходе этого процесса никель восстанавливается. В присутствии CO Ni-L образует состояние Ni-CO .

Созревание и генетическая организация
Созревание гидрогеназ [NiFe] требует набора вспомогательных белков, которые синтезируют активный центр NiFe и модифицируют фермент-предшественник таким образом, чтобы он имел правильную структуру и местоположение. [2] [16] [17] Созревание активного центра представляет особый интерес из-за синтеза металлических лигандов цианида (CN) и оксида углерода (CO), которые обычно токсичны для живых организмов. [16] Этот этап завершается белками HypC, HypD, HypE и HypF. [17 ] [18] После синтеза железного центра никель вставляется с использованием металлошаперонов HypA, HypB и SlyD. [ 17] [18] После завершения каталитического центра предшественник гидрогеназы подвергается расщеплению С-конца, что вызывает перестройку его структуры и ассоциацию с малой субъединицей. [16] [17] [18] Наконец, готовый фермент транспортируется в правильное положение внутри клетки. [16] [17] [18] Промотор гидрогеназы, P SH , можно изучить, сконструировав слияние промотора P SH- gfp с использованием репортерного гена зеленого флуоресцентного белка ( gfp) . [19]
Приложение
Поскольку [NiFe] гидрогеназа является членом семейства гидрогеназ , эти ферменты могут катализировать как потребление, так и производство водорода. [1] Изучая [NiFe] гидрогеназу, ученые могут оптимизировать состояние, в котором белок будет производить только водород. Кроме того, небольшой ферментный имитатор [NiFe] гидрогеназы также может быть синтезирован для работы в качестве генератора газообразного водорода. Растворимая [NiFe] гидрогеназа из Ralstonia eutropha H16 является перспективным кандидатом на фермент для применения в качестве биотоплива на основе H2 , поскольку она способствует окислению H2 и относительно устойчива к кислороду. Ее можно производить на гетеротрофных средах для роста [20] и очищать с помощью матриц анионообменной и эксклюзионной хроматографии . [21]
Смотрите также
Ссылки
- ^ ab Jugder, Bat-Erdene; Welch, Jeffrey; Aguey-Zinsou, Kondo-Francois; Marquis, Christopher P. (2013-05-14). "Основы и электрохимические применения гидрогеназ поглощения [Ni–Fe]". RSC Advances . 3 (22): 8142. doi :10.1039/c3ra22668a. ISSN 2046-2069.
- ^ abc Vignais, Paulette M.; Billoud, Bernard (октябрь 2007 г.). «Возникновение, классификация и биологическая функция гидрогеназ: обзор». Chemical Reviews . 107 (10): 4206– 4272. doi :10.1021/cr050196r. PMID 17927159.
- ^ Volbeda, A.; Garcin, E.; Piras, C.; de Lacey, AL; Fernandez, VM; Hatchikian, EC; Frey, M.; Fontecilla-Camps, JC (1996). «Структура активного сайта [NiFe] гидрогеназы: доказательства биологически необычных лигандов Fe». J. Am. Chem. Soc . 118 (51): 12989– 12996. doi :10.1021/ja962270g.
- ^ ab Eidsness, MK; Scott, RA; Prickril, BC; DerVartanian, DV; Legall, J.; Moura, I.; Moura, JJ; Peck, HD (1989). «Доказательства координации селеноцистеина с никелем активного центра в [NiFeSe]гидрогеназах из Desulfovibrio baculatus». Труды Национальной академии наук . 86 (1): 147– 151. doi : 10.1073/pnas.86.1.147 . PMC 286421. PMID 2521386 .
- ^ abc Jmol: Java-просмотрщик с открытым исходным кодом для химических структур в 3D. http://www.jmol.org/
- ^ Хигучи, Y.; Яги, T.; Ясуока, N. (1997). «Необычная структура лиганда в активном центре Ni-Fe и дополнительный участок Mg в гидрогеназе, выявленные с помощью рентгеноструктурного анализа высокого разрешения». Структура . 5 (12): 1671– 1680. doi : 10.1016/s0969-2126(97)00313-4 . PMID 9438867.
- ^ Volbeda, A.; Charon, M.-H.; Piras, C.; Hatchikian, EC; Frey, M.; Fontecilla-Camps, JC (1995). "Кристаллическая структура никель-железной гидрогеназы из Desulfovibrio gigas". Nature . 373 (6515): 580– 587. doi :10.1038/373580a0. PMID 7854413. S2CID 4335445.
- ^ Volbeda, A.; Martin, L.; Cavazza, C.; Matho, M.; Faber, BW; Roseboom, W.; Albracht, SPJ; Garcin, E.; Rousset, M.; Fontecilla-Camps, JC (2005). «Структурные различия между готовыми и неготовыми окисленными состояниями [NiFe] гидрогеназ». Журнал биологической неорганической химии . 10 (3): 239– 249. doi :10.1007/s00775-005-0632-x. PMID 15803334. S2CID 25953517.
- ^ Montet, Y.; Amara, P.; Volbeda, A.; Vernede, X.; Hatchikian EC; Field, MJ; Frey, M.; Fontecilla-Camps, JC (1997). «Доступ газа к активному центру Ni-Fe-гидрогеназ, исследованный с помощью рентгеновской кристаллографии и молекулярной динамики». Nature Structural & Molecular Biology . 4 (7): 523– 526. doi :10.1038/nsb0797-523. PMID 9228943. S2CID 19356968.
- ^ Matias, PM; Soares, CM; Saraiva, LM; Coelho, R.; Morais, J.; Le Gall, J.; Carrondo, MA (2001). "[NiFe] гидрогеназа из Desulfovibrio desulfuricans ATCC 27774: секвенирование генов, определение и уточнение трехмерной структуры при 1,8 Å и модельные исследования ее взаимодействия с цитохромом тетрагема c3". Журнал биологической неорганической химии . 6 (1): 63–81 . doi :10.1007/s007750000167. PMID 11191224. S2CID 9661059.
- ^ Garcin, E.; Vernede, X.; Hatchikian, EC; Volbeda, A.; Frey, M.; Fontecilla-Camps, JC (1999). «Кристаллическая структура восстановленной [NiFeSe] гидрогеназы дает изображение активированного каталитического центра». Structure . 7 (5): 557– 566. doi : 10.1016/s0969-2126(99)80072-0 . PMID 10378275.
- ^ ab Chiou, T.-W.; Liaw, W.-F. (2008). "Никель-тиолатные и железо-тиолатные цианокарбонильные комплексы: Моделирование никелевых и железных участков гидрогеназы [NiFe]". Comptes Rendus Chimie . 11 (8): 818– 833. doi :10.1016/j.crci.2008.04.003.
- ^ abcdefghi Огата, Х.; Любиц, В.; Хигучи, И. (2009). «[NiFe] гидрогеназы: структурные и спектроскопические исследования механизма реакции». Dalton Trans . 37 (37): 7577– 7587. doi :10.1039/b903840j. PMID 19759926.
- ^ Ламеле, SE; Альбрахт, SPJ; Армстронг, FA (2004). «Исследования электрохимического потенциала-шага аэробных взаимопревращений [NiFe]-гидрогеназы из Allochromatium vinosum: понимание загадочной разницы между неготовыми и готовыми окисленными неактивными состояниями». Журнал Американского химического общества . 126 (45): 14899– 14909. doi :10.1021/ja047939v. PMID 15535717.
- ^ Огата, Х.; Мидзогучи, Ю.; Мизуно, Н.; Мики, К.; Адачи, С.-и.; Ясуока, Н.; Яги, Т.; Ямаути, О.; Хирота, С.; Хигучи, Ю. (2002). «Структурные исследования комплекса оксида углерода [NiFe]гидрогеназы из Desulfovibrio vulgaris Miyazaki F: Предложение относительно начального сайта активации для дигидрогена». Журнал Американского химического общества . 124 (39): 11628– 11635. doi :10.1021/ja012645k. PMID 12296727.
- ^ abcd Любиц, Вольфганг ; Огата, Хидеаки; Рюдигер, Олаф; Рейджерс, Эдвард (23 апреля 2014 г.). «Гидрогеназы». Химические обзоры . 114 (8): 4081–4148 . doi : 10.1021/cr4005814. ПМИД 24655035.
- ^ abcde Лакасс, Майкл Дж.; Замбл, Дебора Б. (29 марта 2016 г.). «Созревание [NiFe]-гидрогеназы». Биохимия . 55 (12): 1689– 1701. doi :10.1021/acs.biochem.5b01328. PMID 26919691.
- ^ abcd Peters, John W.; Schut, Gerrit J.; Boyd, Eric S.; Mulder, David W.; Shepard, Eric M.; Broderick, Joan B.; King, Paul W.; Adams, Michael WW (июнь 2015 г.). «Разнообразие, механизм и созревание [FeFe]- и [NiFe]-гидрогеназ». Biochimica et Biophysica Acta (BBA) - Molecular Cell Research . 1853 (6): 1350– 1369. doi : 10.1016/j.bbamcr.2014.11.021 . PMID 25461840.
- ^ Джагдер, Бат-Эрден; Уэлч, Джеффри; Брейди, Нади; Маркиз, Кристофер П. (2016-07-26). "Конструирование и использование слияния промотора растворимой гидрогеназы (PSH) Cupriavidus necatorH16 с gfp (зеленым флуоресцентным белком)". PeerJ . 4 : e2269. doi : 10.7717/peerj.2269 . ISSN 2167-8359. PMC 4974937 . PMID 27547572.
- ^ Джагдер, Бат-Эрден; Чэнь, Чжилян; Пин, Даррен Тан Тек; Лебхар, Хелен; Уэлч, Джеффри; Маркиз, Кристофер П. (2015-03-25). "Анализ изменений в растворимой гидрогеназе и глобальной экспрессии генов у Cupriavidus necator (Ralstonia eutropha) H16, выращенного в гетеротрофной диауксиновой периодической культуре". Microbial Cell Factories . 14 (1): 42. doi : 10.1186/s12934-015-0226-4 . ISSN 1475-2859. PMC 4377017. PMID 25880663 .
- ^ Джагдер, Бат-Эрдене; Лебхар, Элен; Агуэй-Зинсу, Кондо-Франсуа; Маркиз, Кристофер П. (2016-01-01). «Производство и очистка растворимой гидрогеназы из Ralstonia eutropha H16 для потенциальных применений в водородных топливных элементах». MethodsX . 3 : 242– 250. doi :10.1016/j.mex.2016.03.005. PMC 4816682 . PMID 27077052.
