Перегруппировка Мейера–Шустера
| Перегруппировка Мейера–Шустера | |
|---|---|
| Назван в честь | Курт Генрих Мейер Курт Шустер |
| Тип реакции | Реакция перегруппировки |
| Идентификаторы | |
| Идентификатор онтологии RSC | Номер заказа:0000476 |
Перегруппировка Мейера-Шустера — это химическая реакция , описываемая как катализируемая кислотой перегруппировка вторичных и третичных пропаргиловых спиртов в α,β-ненасыщенные кетоны , если алкиновая группа является внутренней, и в α,β-ненасыщенные альдегиды , если алкиновая группа является терминальной. [1] Обзоры были опубликованы Сваминатаном и Нараяном, [2] Вартаняном и Банбаньяном, [3] и Энгелем и Дадли, [4], последний из которых описывает способы ускорения перегруппировки Мейера-Шустера по сравнению с другими реакциями, доступными для пропаргиловых спиртов.
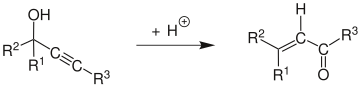
Механизм

Механизм реакции [5] начинается с протонирования спирта, который в реакции E1 образует аллен из алкина . Атака молекулы воды на карбокатион и депротонирование сопровождаются таутомеризацией с образованием α,β-ненасыщенного карбонильного соединения .
Эденс и др. исследовали механизм реакции. [6] Они обнаружили, что он характеризуется тремя основными этапами: (1) быстрое протонирование кислорода, (2) медленный, определяющий скорость этап, включающий 1,3-сдвиг протонированной гидроксильной группы, и (3) кето-енольная таутомерия, за которой следует быстрое депротонирование.
В исследовании ограничивающего скорость этапа реакции Мейера-Шустера Андрес и др. показали, что движущей силой реакции является необратимое образование ненасыщенных карбонильных соединений через ионы карбония . [7] Они также обнаружили, что реакция сопровождается растворителем. Это было дополнительно исследовано Тапиа и др., которые показали, что связывание растворителя стабилизирует переходное состояние . [8]
перегруппировка Рупе
Реакция третичных спиртов, содержащих α- ацетиленовую группу, не приводит к образованию ожидаемых альдегидов, а скорее α,β-ненасыщенных метилкетонов через промежуточный енин . [9] [10] Эта альтернативная реакция называется реакцией Рупе и конкурирует с перегруппировкой Мейера-Шустера в случае третичных спиртов.


Использование катализаторов
В то время как традиционная перегруппировка Мейера-Шустера использует жесткие условия с сильной кислотой в качестве катализатора, это вводит конкуренцию с реакцией Рупе, если спирт является третичным. [2] Более мягкие условия были успешно использованы с катализаторами на основе переходных металлов и кислот Льюиса (например, катализаторами на основе Ru- [11] и Ag- [12] ). Кадьерно и др. сообщают об использовании микроволнового излучения с InCl в качестве катализатора для получения превосходных выходов при коротком времени реакции и замечательной стереоселективности . [13] Пример из их статьи приведен ниже:
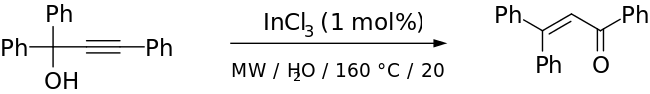
Приложения
Перегруппировка Мейера-Шустера использовалась в различных приложениях, от превращения ω-алкинил-ω-карбиноллактамов в енамиды с использованием каталитической ПТСК [14] до синтеза α,β-ненасыщенных тиоэфиров из γ-серозамещенных пропаргиловых спиртов [15] и перегруппировки 3-алкинил-3-гидроксил-1H - изоиндолов в слабокислых условиях с получением α,β-ненасыщенных карбонильных соединений. [16] Однако одним из наиболее интересных приложений является синтез части паклитаксела диастереомерно - селективным способом , который приводит только к E -алкену. [17]

Показанный выше шаг имел выход 70% (91%, когда побочный продукт был преобразован в продукт Майера-Шустера на другом шаге). Авторы использовали перегруппировку Майера-Шустера, поскольку они хотели преобразовать затрудненный кетон в алкен, не разрушая остальную часть своей молекулы.
Ссылки
- ^ Мейер, К.Х.; Шустер, К. Бер. 1922 , 55 , 819.( doi :10.1002/cber.19220550403)
- ^ ab Сваминатан, С.; Нараян, К. В. «Перегруппировки Рупа и Мейера-Шустера» Chem. Rev. 1971 , 71 , 429–438. (Обзор)
- ^ Вартанян, С.А.; Банбанян, С.О. Русс. хим. 1967 , 36 , 670. (Обзор)
- ^ Энгель, ДА; Дадли, ГБ Органическая и биомолекулярная химия 2009 , 7 , 4149–4158. (Обзор)
- ^ Ли, Дж. Дж. В перегруппировке Мейера-Шустера ; Реакции имен: сборник подробных механизмов реакций; Springer: Berlin, 2006; стр. 380–381.( doi :10.1007/978-3-642-01053-8_159)
- ^ Эденс, М.; Бёрнер, Д.; Чейз, К. Р.; Насс, Д.; Скьявелли, М. Д. J. Org. Chem. 1977 , 42 , 3403–3408. ( doi :10.1021/jo00441a017)
- ^ Андрес, Дж.; Карденас, Р.; Силла, Э.; Тапиа, O.J. Am. хим. Соц. 1988 , 110 , 666–674. ( дои : 10.1021/ja00211a002)
- ^ Тапиа, О.; Ллуч, Дж. М.; Кардена, Р.; Андрес, JJ Am. хим. Соц. 1989 , 111 , 829–835. ( дои : 10.1021/ja00185a007)
- ^ Рупе, Х.; Камбли, Э. Хелв. Хим. Acta 1926 , 9 , 672. ( doi :10.1002/hlca.19260090185)
- ^ Ли, Дж. Дж. В перегруппировке Рупе ; Реакции имен: сборник подробных механизмов реакций; Springer: Berlin, 2006; стр. 513–514.( doi :10.1007/978-3-642-01053-8_224)
- ^ Кадьерно, В.; Крючком, П.; Гимено, Дж. Синлетт 2008 , 1105–1124. ( дои : 10.1055/с-2008-1072593)
- ^ Сугавара, Ю.; Ямада, В.; Ёсида, С.; Икено, Т.; Ямада, T.J. Am. хим. Соц. 2007 , 129 , 12902-12903. ( дои : 10.1021/ja074350y)
- ^ Кадьерно, В.; Франкос, Дж.; Гимено, Дж. Тетраэдр Летт. 2009 , 50 , 4773–4776.( doi :10.1016/j.tetlet.2009.06.040)
- ^ Чихаб-Эддин, А.; Дайч, А.; Джилале, А.; Декруа, Б.Ж. Гетероцикл. хим. 2000 , 37 , 1543–1548.( doi :10.1002/jhet.5570370622)
- ^ Ёсимацу, М.; Найто, М.; Кавахигаси, М.; Симидзу, Х.; Катаока, TJ Org. хим. 1995 , 60 , 4798–4802.( doi :10.1021/jo00120a024)
- ^ Омар, EA; Ту, C.; Вигал, CT; Браун, LL J. Heterocycl. Chem. 1992 , 29 , 947–951.( doi :10.1002/jhet.5570290445)
- ^ Крич, Д.; Натараджан, С.; Крич, Дж. З. Тетраэдр 1997 , 53 , 7139–7158. ( doi : 10.1016/S0040-4020(97)00411-0)
