Область прикрепления каркаса/матрицы
Термин S/MAR ( scaffold/matrix attached region ), иначе называемый SAR ( scaffold-attachment region ) или MAR ( matrix-associated region ), представляет собой последовательности в ДНК эукариотических хромосом, где прикрепляется ядерный матрикс . Как архитектурные компоненты ДНК, которые организуют геном эукариот в функциональные единицы внутри клеточного ядра , S/MAR опосредуют структурную организацию хроматина внутри ядра. Эти элементы представляют собой опорные точки ДНК для хроматинового каркаса и служат для организации хроматина в структурные домены . Исследования отдельных генов привели к выводу, что динамическая и сложная организация хроматина, опосредованная элементами S/MAR, играет важную роль в регуляции экспрессии генов .
Обзор
Известно уже много лет, что полимерная сетка, так называемая « ядерная матрица » или «ядерный каркас», является неотъемлемым компонентом эукариотических ядер. Этот ядерный скелет действует как динамическая поддержка для многих специализированных событий, касающихся считывания и распространения генетической информации (см. ниже).
S/MAR сопоставляются с неслучайными локациями в геноме. Они встречаются на флангах транскрибируемых областей, в 5´- интронах , а также в областях кластера точек разрыва генов (BCR). Будучи точками ассоциации для общих ядерных структурных белков, S/MAR необходимы для аутентичной и эффективной репликации и транскрипции хромосом , для рекомбинации и конденсации хромосом. S/MAR не имеют очевидной консенсусной последовательности. Хотя прототипные элементы состоят из областей, богатых AT, длиной в несколько сотен пар оснований, общий состав оснований определенно не является основным фактором, определяющим их активность. Вместо этого их функция требует паттерна «AT-заплат», который придает склонность к локальному распариванию нитей при торсионной деформации .
Биоинформатические подходы поддерживают идею о том, что благодаря этим свойствам S/MAR не только отделяют данную транскрипционную единицу (домен хроматина) от ее соседей, но и предоставляют платформы для сборки факторов, обеспечивающих транскрипционные события в пределах данного домена. Повышенная склонность к разделению цепей ДНК (так называемый потенциал «дестабилизации дуплекса, вызванной стрессом», SIDD ) может служить образованию вторичных структур, таких как крестообразные или проскальзывающие структуры , которые являются узнаваемыми признаками для ряда ферментов ( ДНКазы , топоизомеразы , поли(АДФ-рибозил)полимеразы и ферменты аппарата ацетилирования гистонов и метилирования ДНК). S/MAR были классифицированы как конститутивные (действующие как постоянные границы доменов во всех типах клеток) или факультативные (связанные с типом и активностью клеток) в зависимости от их динамических свойств.
Хотя число S/MAR в геноме человека оценивается примерно в 64 000 (домены хроматина) плюс еще 10 000 (фокусы репликации), в 2007 году лишь незначительная часть (559 для всех эукариот) соответствовала стандартным критериям для аннотации в базе данных S/MARt. [1]
Контекстно-зависимые свойства
Современные взгляды на ядерный матрикс представляют его как динамическую сущность, которая изменяет свои свойства в соответствии с требованиями клеточного ядра — примерно так же, как цитоскелет адаптирует свою структуру и функцию к внешним сигналам. Оглядываясь назад, следует отметить, что открытие S/MARs имело два основных пути:
- описание элементов прикрепления каркаса (SAR) Леммли и его коллегами, которые, как считалось, разграничивают границы данного домена хроматина [2]
- характеристика областей, связанных с матриксом (MAR), первые примеры которых подтверждали наличие усилителя капп-цепи иммуноглобулина в соответствии с его занятостью факторами транскрипции [3]
Последующие работы продемонстрировали как конститутивную (подобную SAR), так и факультативную (подобную MAR) функцию элементов в зависимости от контекста. В то время как конститутивные S/MAR, как было обнаружено, связаны с гиперчувствительным к ДНКазе I сайтом во «всех» типах клеток (независимо от того, транскрибировался ли включенный домен), гиперчувствительность к ДНКазе I факультативного типа зависела от транскрипционного статуса. [4] Основное различие между этими двумя функциональными типами S/MAR заключается в их размере: конститутивные элементы могут простираться на несколько тысяч пар оснований, тогда как факультативные находятся на нижнем пределе размера около 300 пар оснований.
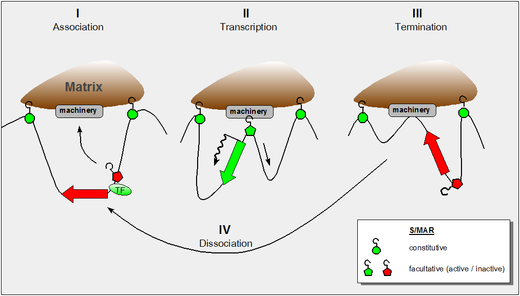
Рисунок демонстрирует наше современное понимание этих свойств и включает в себя следующие выводы:
- динамические свойства контактов S/MAR-скеффолд, полученные с помощью исследований haloFISH [5]
- тот факт, что во время транскрипции ДНК прокручивается через РНК-полимеразу, которая сама по себе является фиксированным компонентом ядерного матрикса [6]
- тот факт, что некоторые доменные S/MAR требуют поддержки соседнего фактора транскрипции, чтобы стать активными. [4]
Использование в генной терапии
В качестве альтернативы вирусным векторам, которые могут иметь нежелательные эффекты в организме пациента, изучаются невирусные методы генной терапии. Один из таких методов использует плазмиды со специальными свойствами - так называемые эписомы . Эписомы обладают способностью делиться вместе с остальной частью эукариотического генома во время митоза. По сравнению со стандартными плазмидами они не эпигенетически подавляются в ядре и не разрушаются ферментативно. Эписомы приобретают эту способность благодаря наличию последовательности S/MAR в их конструкции. [7]
Дополнительная информация
В 2006 году Тетко обнаружил сильную корреляцию внутригенных S/MAR с пространственно-временной экспрессией генов у Arabidopsis thaliana . [8] В масштабе генома были обнаружены выраженные ткане- и органоспецифичные и развивающиеся паттерны экспрессии генов, содержащих S/MAR. Примечательно, что гены факторов транскрипции содержат значительно более высокую долю S/MAR. Выраженное различие в характеристиках экспрессии генов, содержащих S/MAR, подчеркивает их функциональную значимость и важность структурных хромосомных характеристик для регуляции генов как у растений, так и у других эукариот.
Ссылки
- ^ "SMARtDB". Кафедра биоинформатики . Гёттинген, Германия: Гёттингенский университет.
- ^ Mirkovitch J, Mirault ME, Laemmli UK (ноябрь 1984 г.). «Организация петли хроматина высшего порядка: специфические сайты прикрепления ДНК на ядерном каркасе». Cell . 39 (1): 223– 232. doi :10.1016/0092-8674(84)90208-3. PMID 6091913. S2CID 24634819.
- ^ Cockerill PN, Garrard WT (январь 1986). «Закрепление гена иммуноглобулина каппа на хромосомной петле происходит рядом с энхансером в области, содержащей сайты топоизомеразы II». Cell . 44 (2): 273– 282. doi :10.1016/0092-8674(86)90761-0. PMID 3002631. S2CID 26202934.
- ^ ab Klar M, Stellamanns E, Ak P, Gluch A, Bode J (декабрь 2005 г.). «Доминирующие геномные структуры: обнаружение и потенциальные сигнальные функции в домене интерферона-бета». Gene . 364 : 79– 89. doi :10.1016/j.gene.2005.07.023. PMID 16185826.
- ^ Heng HH, Goetze S, Ye CJ, Liu G, Stevens JB, Bremer SW и др. (март 2004 г.). «Петли хроматина селективно закреплены с использованием областей прикрепления к каркасу/матриксу». Journal of Cell Science . 117 (Pt 7): 999– 1008. doi :10.1242/jcs.00976. PMID 14996931.
- ^ Джексон ДА, Долль А, Робертсон Г, Кук ПР (август 1992). «Прикрепление петель хроматина к нуклеоскелету». Cell Biology International Reports . 16 (8): 687– 696. doi :10.1016/s0309-1651(05)80013-x. PMID 1446346.
- ^ Mulia GE, Picanço-Castro V, Stavrou EF, Athanassiadou A, Figueiredo ML (октябрь 2021 г.). «Достижения в разработке и применении невирусных эписомальных векторов для генной терапии». Human Gene Therapy . 32 ( 19– 20): 1076– 1095. doi : 10.1089/hum.2020.310. PMC 8819515. PMID 34348480 .
- ^ Tetko IV, Haberer G, Rudd S, Meyers B, Mewes HW, Mayer KF (март 2006 г.). "Пространственно-временной контроль экспрессии коррелирует с внутригенными областями прикрепления матрицы каркаса (S/MAR) у Arabidopsis thaliana". PLOS Computational Biology . 2 (3): e21. doi : 10.1371/journal.pcbi.0020021 . PMC 1420657 . PMID 16604187.