Манделонитриллиаза
| ( R )-миндальная нитриллиаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 4.1.2.10 | ||||||||
| Номер CAS | 9024-43-5 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
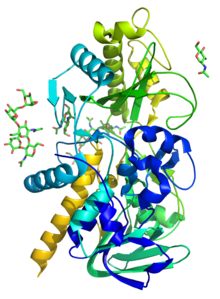
Фермент ( R )-миндальная нитриллиаза ( EC 4.1.2.10, (R)-HNL , (R ) -оксинитрилаза , (R)-гидроксинитриллиаза ) катализирует химическую реакцию
- миндальный нитрил цианистый водород + бензальдегид
Этот фермент принадлежит к семейству лиаз , а именно альдегидлиаз, которые расщепляют углерод-углеродные связи. Систематическое название этого класса ферментов — манделонитрилбензальдегидлиаза (циановодородобразующая) . Другие общеупотребительные названия включают гидроксинитриллиазу , (R)-оксинитрилазу , оксинитрилазу , D-оксинитрилазу , D-альфа-гидроксинитриллиазу и манделонитрилбензальдегидлиазу . Этот фермент участвует в метаболизме цианоаминокислот. Он имеет 2 кофактора : флавин и флавопротеин .
Историческая перспектива
Манделонитриллиазы, более разговорно называемые HNL (гидроксинитриллиазы), были впервые охарактеризованы Вёлером в 1938 году на основании их высокой активности в миндале. [1] С тех пор HNL были выделены из самых разных растений, включая косточковые фрукты, [2] зерна сорго, [3] многоножки, [4] и маракуйю. [5]
HNLs специфичны тем, что в пределах одного организма и даже одного образца существует множество различных изоформ этого фермента. Эти изоформы невозможно отличить друг от друга на основе факторов, влияющих на активность. [6] Это разнообразие также является результатом макрогетерогенности, поскольку некоторые изоформы связывают FAD на своем N-конце, в то время как другие не способны связывать FAD. Понятно, что это так, поскольку N-концевая складка является областью, которая, как известно, связывает FAD как необходимый кофактор . Также любопытно, что FAD не играет наблюдаемой роли в окислительно-восстановительных реакциях активного центра этого фермента. [1] Те HNLs, которые связывают FAD, делают это в гидрофобной области, соседствующей с активным центром, где, как полагают, связывание FAD придает структурную стабильность, которая позволяет осуществлять ферментативное действие. Эти HNL, называемые HNL класса I (или HNL I), также отмечены как имеющие N-концевое гликозилирование и отчетливую гетерогенность и наличие изоформ в пределах одного организма. HNL класса II (HNL II), с другой стороны, предоставляют более широкий спектр субстратов и в целом благоприятствуют (S) стереохимии , тогда как HNL I стереоселективно производят (R)-миндальный нитрил. [1]
Структура и действие
Благодаря простой очистке этого фермента (5-30-кратной очистки достаточно для достижения гомогенности), его биологический и биохимический анализ были очень тщательно изучены. [1] В дополнение к изучению многих изоформ в пределах данного организма, было проведено исследование, посвященное пониманию локализации HNL , физической структуры фермента и его активного центра, а также механизмов, с помощью которых он способен опосредовать этот важный набор реакций. После очистки HNL черной вишни , исследования Ву и Поултона [7] повысили антисыворотку к этим специфическим HNL, которые затем были нанесены (с частицами коллоидного золота на буксире) на семядоли и эндосперм черной вишни . Здесь было обнаружено, что HNL в подавляющем большинстве локализуется в клеточных стенках этих развивающихся растений. [7] Он был настолько обогащен в этих областях, что было отмечено, что более 5% изображений клеточных стенок , полученных с помощью электронной микроскопии, отображали золотые частицы, которые косвенно маркировали эти белки. [7]
Зная, где этот белок высоко локализован, на рисунке 1 подробно описана работа, которая подчеркивает структуру этого белка и остатки в его активном центре соответственно. Особый интерес представляют HNL, использующие каталитически активный остаток Cys . [5] В то время как остатки цистеина сохраняются во всех видах в трех отдельных местах (в N-концевом сайте связывания FAD и два в C-концевом активном центре), похоже, что каталитически активный остаток находится вблизи активного центра, что предполагает важную роль в каталитическом действии HNL. Другие структурные особенности, указывающие на HNL, разделены на основе их класса. В то время как HNL класса II известны как более гетерогенные и чаще встречаются в зернах , HNL класса I более типичны для связывания FAD и функционируют как белки запаса семян . Это действие позволяет увеличить метаболизм аминокислот в развивающихся семенах. Поскольку фермент способен быстро обратить эту реакцию вспять, чтобы создать цианистый водород , HNL играют важную роль в защите семян [6] [1]
По состоянию на конец 2007 года для этого класса ферментов была решена только одна структура с кодом доступа PDB 1JU2.
Механизм действия


Известно, что HNL стереоспецифичны , что дает действию этого фермента большое преимущество в эффективном создании предшественников, необходимых для метаболического развития аминокислот и широкого спектра клинически значимых малых молекул. Однако было установлено, что большое разнообразие организмов и изоформ, составляющих семейство HNL, дает множество различных механизмов , которые облегчают эту реакцию стереоспецифическим образом . На рисунках 2 и 3 подробно описаны типичные синтетические и решенные биохимические механизмы для образования этого ключевого метаболического промежуточного продукта. Ключевые различия между этими путями в основном основаны на отсутствии энантиомерной специфичности, придаваемой синтетическими путями, несмотря на использование схожих классов реакций . Кроме того, большинство синтетических методов для облегчения этого набора реакций происходят в органическом растворителе , тогда как было показано, что активность HNL является самой высокой на полярно-неполярном интерфейсе . [1] [13]
Актуальность заболевания
HNL и действие, которое они опосредуют, являются ключевой целью для изучения белковой инженерии , поскольку образование нитрила миндальной кислоты является ключевым шагом в широком спектре органических синтезов с медицинским и терапевтическим потенциалом. Шаг, опосредованный этими ферментами, необходим для синтеза стереоспецифического образования связей в бронходилататорах (R)-сальбутамол , [14] (S) -амфетаминах , [14] (1R, 2S)-(-)- эфедриновых бронходилататорах, [15] в дополнение ко многим другим, включая Липитор , [16] Талидомид , [17] и полусинтез цефалоспориновых антибиотиков . [18] Важность этих синтонов нитрила миндальной кислоты делает класс ферментов HNL основной целью для контролируемого катализа , который был оптимизирован посредством работы на границе полярных и неполярных условий растворителя. [1] [13]
Ссылки
- ^ abcdefgh Шарма, Моника; Шарма, Нитья Нанд; Бхалла, Тек Чанд (август 2005 г.). «Гидроксинитриллиазы: на стыке биологии и химии». Enzyme and Microbial Technology . 37 (3): 279–294. doi :10.1016/j.enzmictec.2005.04.013.
- ^ Yemm RS, Poulton JE (1986). «Выделение и характеристика множественных форм манделонитриллиазы из зрелых семян черной вишни (Prunus serotina Ehrh.)». Arch. Biochem. Biophys . 247 (2): 440–5. doi :10.1016/0003-9861(86)90604-1. PMID 3717954.
- ^ Бовти, К., и Конн, Э.Э. (1961) J. Bid Cfiem 236,207-210.
- ^ Дадашипур М., Ишида И., Ямамото К., Асано И. (2015). «Открытие и молекулярные и биокаталитические свойства гидроксинитриллиазы из инвазивной многоножки Chamberlinius hualienensis». Труды Национальной академии наук . 112 (34): 10605–10610. Bibcode : 2015PNAS..11210605D. doi : 10.1073/pnas.1508311112 . PMC 4553793. PMID 26261304 .
- ^ ab Nuylert A, Asano Y (2018). «Кристаллическая структура и каталитический механизм гидроксинитриллиазы из маракуйи, Passiflora edulis». FEBS J. 285 ( 2): 313–324. doi : 10.1111/febs.14339 . PMID 29155493.
- ^ ab Hu Z, Poulton JE (1999). "Молекулярный анализ микрогетерогенности (R)-(+)-манделонитриллиазы в черной вишне". Plant Physiol . 119 (4): 1535–46. doi : 10.1104/pp.119.4.1535 . PMC 32039. PMID 10198113 .
- ^ abc Wu H, Poulton JE (1991). "Иммуноцитохимическая локализация манделонитриллиазы в зрелых семенах черной вишни (Prunus serotina Ehrh.)". Физиология растений . 96 (4): 1329–1337. doi : 10.1104/pp.96.4.1329 . PMC 1080934. PMID 16668338 .
- ^ Corson, BB; Dodge, RA; Harris, SA; Yeaw, JS (1941). "Миндальная кислота". Органические синтезы.; Коллективный том, 1, стр. 336
- ^ Грубер К (2001). «Выяснение способа связывания субстрата с гидроксинитриллиазой из Hevea brasiliensis ». Белки . 44 (1): 26–31. doi :10.1002/prot.1068. PMID 11354003. S2CID 19757228.
- ^ Dreveny I, Kratky C, Gruber K (2002). «Активный центр гидроксинитриллайазы из Prunus amydalus, модельные исследования дают новое представление о механизме цианогенеза». Protein Sci . 11 (2): 293–300. doi :10.1110/ps.38102. PMC 2373431. PMID 11790839 .
- ^ Lauble H, Miehlich B, Forster S, Wajant H, Effenberger F (2002). «Кристаллическая структура гидроксинитриллиазы из Sorghum bicolor в комплексе с ингибитором бензойной кислотой, новым цианогенным ферментом». Биохимия . 41 (40): 12043–12050. doi :10.1021/bi020300o. PMID 12356304.
- ^ Lauble H, Miehlich B, Forster S, Wajant H, Effenberger (2001). "Механистические аспекты цианогенеза из мутанта активного сайта Ser80Ala гидроксинитриллиазы для Manihot escuelenta в комплексе с ацетонциангидрином". Protein Sci . 10 (5): 1015–1022. doi :10.1110/ps.01301. PMC 2374195. PMID 11316882 .
- ^ ab Wehtje E, Adlercreutz P, Mattiasson B (1990). «Формирование связей CC с помощью манделонитриллиазы в органических растворителях». Биотехнология и биоинженерия . 36 (1): 39–46. doi :10.1002/bit.260360106. PMID 18592607. S2CID 22377329.
- ^ ab Effenberger F, Jager J (1997). «Синтез адрегенерических бронходилататоров (R)-тербуталина и (R)-сальбутамола из (R)-циангидринов». J. Org. Chem . 62 (12): 3867–3873. doi :10.1021/jo970032d.
- ^ Джексон В. Р., Якоб Х. А., Мэтью Б. Р., Джаятилаке Г. С., Уотсон К. Г. Стереоселективные синтезы эфедрина и родственных 2-аминоспиртов высокой оптической чистоты из защищенных циангидринов. Tetrahedron Lett. 1990; 31:1447-1450
- ^ Морин АР. Биокатализ, шумиха и сделки подчеркивают интерес к биотехнологическим методам улучшения химических процессов. Chem Eng News 2002; 80:86
- ^ Циглер Т., Хорш Б., Эффенбергер Ф., Удобный путь к (R)-α-гидроксикарбоновым кислотам и (2R)-1-амин-2-алканолам из (R)-циангидринов. Синтез 1990:575-578.
- ^ Menendez E., Brieva R., Rebolledo F., Gotor V. Оптически активные (S) кетон и (R) циангидрины через катализируемую (R)-оксинитрилаза трансформацию химико-ферментативного синтеза 2-цианотетрагидрофурана и 2-цианотетрагидропирана. J Chem Soc, Chem Commun. 1995:989-990
- BECKER W, BENTHIN U, ESCHENHOF E, PFEIL E (1963). "[О знании синтеза циангидрина. II. Очистка и свойства гидроксинитрилазы из горького миндаля (Prunus communis Stokes)]". Biochem. Z . 337 : 156–66. PMID 13970146.
- Беккер В; Пфейл Э (1964). «Die Darstellung kristallisierter Oxynitrilase aus Bitten Mandeln (Prunus comm. Stks)». Naturwissenschaften . 51 (8): 193. Бибкод : 1964NW.....51..193B. дои : 10.1007/BF00600723. S2CID 37760196.
- Gross M, Jacobs GH, Poulton JE (1982). «Быстрый и чувствительный спектрофотометрический анализ активности гидролазы пруназина с использованием очищенной манделонитриллиазы». Anal. Biochem . 119 (1): 25–30. doi :10.1016/0003-2697(82)90660-1. PMID 6803611.
- Xu LL, Singh BK, Conn EE (1986). «Очистка и характеристика манделонитриллиазы из Prunus lyonii». Arch. Biochem. Biophys . 250 (2): 322–8. doi :10.1016/0003-9861(86)90733-2. PMID 3777939.
- Yemm RS, Poulton JE (1986). "Выделение и характеристика множественных форм манделонитриллиазы из зрелых семян черной вишни (Prunus serotina Ehrh.)". Arch. Biochem. Biophys . 247 (2): 440–5. doi :10.1016/0003-9861(86)90604-1. PMID 3717954.


