Белок O-GlcNAcase
| ОГА | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | OGA , MEA5, NCOAT, экспрессируемый менингиомой антиген 5 (гиалуронидаза), MGEA5, O-GlcNAcase | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 604039; МГИ : 1932139; гомологен : 8154; GeneCards : OGA; ОМА :ОГА - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Протеин O -GlcNAcase ( EC 3.2.1.169, OGA, гликозидгидролаза O -GlcNAcase, O -GlcNAcase, BtGH84, O -GlcNAc гидролаза) - фермент с систематическим названием (протеин)-3- O -( N -ацетил- D -глюкозаминил)- L -серин/треонин N -ацетилглюкозаминилгидролаза . [5] [6] [7] [8] [9] OGA кодируется геном OGA . Этот фермент катализирует удаление посттрансляционной модификации O -GlcNAc в следующей химической реакции :
- [белок]-3- O -( N -ацетил-β- D -глюкозаминил)- L -серин + H 2 O ⇌ [белок]- L -серин + N -ацетил- D -глюкозамин
- [белок]-3- O- ( N -ацетил-β- D -глюкозаминил) -L -треонин + H2O ⇌ [белок] -L -треонин + N -ацетил- D -глюкозамин
Номенклатура
| Белок O -GlcNAcase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.169 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Другие названия включают:
- Ядерно-цитоплазматическая O -GlcNAcase и ацетилтрансфераза
Изоформы
Ген OGA человека способен производить два различных транскрипта, каждый из которых способен кодировать различные изоформы OGA. Длинная изоформа L-OGA, бифункциональный фермент, обладающий активностью гликозидгидролазы и доменом псевдогистонацетилтрансферазы, в основном находится в цитоплазме и ядре. Короткая изоформа S-OGA, которая проявляет только домен гликозидгидролазы, изначально была описана как находящаяся в ядре. Однако более поздние исследования показали, что S-OGA находится в митохондриях и регулирует выработку реактивного кислорода в этой органелле. [10] Также была описана другая изоформа, возникающая в результате протеолитического расщепления L-OGA. Все три изоформы проявляют активность гликозидгидролазы. [11]
Гомологи
Белок O -GlcNAcases относится к семейству гликозидгидролаз 84 классификации углеводных активных ферментов. [12] Гомологи существуют у других видов, поскольку O -GlcNAcase сохраняется у высших эукариотических видов. В парном выравнивании люди разделяют 55% гомологии с Drosophila и 43% с C. elegans . Drosophila и C. elegans разделяют 43% гомологии. Среди млекопитающих последовательность OGA еще более высококонсервативна. Мышь и человек имеют 97,8% гомологии. Однако OGA не разделяет значительной гомологии с другими белками. Однако короткие отрезки около 200 аминокислот в OGA имеют гомологию с некоторыми белками, такими как гиалуронидаза, предполагаемая ацетилтрансфераза, эукариотический фактор удлинения трансляции-1γ и полипептид 11-1. [13]
Реакция
БелокО-GlcNAцилирование

O -GlcNAcylation — это форма гликозилирования , сайт-специфического ферментативного присоединения сахаридов к белкам и липидам. Эта форма гликозилирования происходит с O -связанным β- N -ацетилглюкозамином или β- O -связанной 2-ацетамидо-2-дезокси- D -гликопиранозой ( O -GlcNAc). В этой форме один сахар (β- N -ацетилглюкозамин) добавляется к остаткам серина и треонина ядерных или цитоплазматических белков. Два консервативных фермента контролируют это гликозилирование серина и треонина: O -GlcNAc трансфераза (OGT) и O -GlcNAcase (OGA). В то время как OGT катализирует присоединение O -GlcNAc к серину и треонину, OGA катализирует гидролитическое расщепление O -GlcNAc из пост-транзиционно модифицированных белков. [14]
OGA является членом семейства гексозаминидаз . Однако, в отличие от лизосомальных гексозаминидаз, активность OGA является самой высокой при нейтральном pH (приблизительно 7) и локализуется в основном в цитозоле. OGA и OGT синтезируются из двух консервативных генов и экспрессируются по всему организму человека с высокими уровнями в мозге и поджелудочной железе. Продукты O -GlcNAc и сам процесс играют роль в эмбриональном развитии, активности мозга, выработке гормонов и множестве других видов деятельности. [15] [16]
Более 600 белков являются мишенями для O -GlcNAcylation. Хотя функциональные эффекты модификации O -GlcNAc не полностью известны, известно, что модификация O -GlcNAc влияет на многие клеточные активности, такие как метаболизм липидов/углеводов и биосинтез гексозамина. Модифицированные белки могут модулировать различные нисходящие сигнальные пути, влияя на транскрипцию и протеомную активность. [17]
Механизм и ингибирование

OGA катализирует гидролиз O -GlcNAc через промежуточный продукт реакции оксазолина . [18] Стабильные соединения, которые имитируют промежуточный продукт реакции, могут действовать как селективные ингибиторы ферментов. Тиазолиновые производные GlcNAc могут использоваться в качестве промежуточного продукта реакции. Примером этого является Thiamet-G, как показано справа. Вторая форма ингибирования может происходить из-за имитации переходного состояния . Семейство ингибиторов GlcNAcstatin использует этот механизм для ингибирования активности OGA. Для обоих типов ингибиторов OGA может быть выбран отдельно от общих лизосомальных гексозаминидаз путем удлинения заместителя C2 в их химической структуре. Это использует преимущество глубокого кармана в активном сайте OGA, что позволяет ему связывать аналоги GlcNAc. [19]
Существует потенциал для регуляции O -GlcNAcase для лечения болезни Альцгеймера . [20] Когда белок тау в мозге гиперфосфорилируется, образуются нейрофибриллярные клубки , которые являются патологическим признаком нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Для лечения этого состояния OGA подвергается воздействию ингибиторов, таких как Тиамет-Г, чтобы предотвратить удаление O -GlcNAc из тау, что помогает предотвратить фосфорилирование тау. [21]
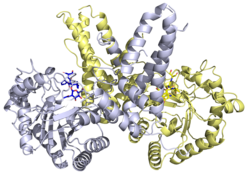
Структура
Рентгеновские структуры доступны для ряда белков O -GlcNAcase. Рентгеновская структура человеческого O -GlcNAcase в комплексе с тиаметом-G определила структурную основу ингибирования фермента. [22]
Смотрите также
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000198408 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000025220 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Уэллс Л., Гао И., Махони JA, Восселлер К., Чен С., Розен А., Харт Г. В. (январь 2002 г.). «Динамическое О-гликозилирование ядерных и цитозольных белков: дальнейшая характеристика ядерно-цитоплазматической бета-N-ацетилглюкозаминидазы, O-GlcNAcase». Журнал биологической химии . 277 (3): 1755– 61. doi : 10.1074/jbc.M109656200 . PMID 11788610.
- ^ Cetinbaş N, Macauley MS, Stubbs KA, Drapala R, Vocadlo DJ (март 2006 г.). «Идентификация Asp174 и Asp175 как ключевых каталитических остатков человеческого O-GlcNAcase с помощью функционального анализа сайт-направленных мутантов». Биохимия . 45 (11): 3835– 44. doi :10.1021/bi052370b. PMID 16533067.
- ^ Dennis RJ, Taylor EJ, Macauley MS, Stubbs KA, Turkenburg JP, Hart SJ и др. (апрель 2006 г.). «Структура и механизм бактериальной бета-глюкозаминидазы с активностью O-GlcNAcase». Nature Structural & Molecular Biology . 13 (4): 365–71 . doi :10.1038/nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Kim EJ, Kang DO, Love DC, Hanover JA (июнь 2006 г.). «Ферментативная характеристика изоформ O-GlcNAcase с использованием флуорогенного субстрата GlcNAc». Carbohydrate Research . 341 (8): 971– 82. doi :10.1016/j.carres.2006.03.004. PMC 10561171. PMID 16584714 .
- ^ Dong DL, Hart GW (июль 1994). «Очистка и характеристика селективной N-ацетил-бета-D-глюкозаминидазы O-GlcNAc из цитозоля селезенки крысы». Журнал биологической химии . 269 (30): 19321– 30. doi : 10.1016/S0021-9258(17)32170-1 . PMID 8034696.
- ^ Pagesy P, Bouaboud A, Feng Z, Hulin P, Issad T (июнь 2022 г.). «Короткий O-GlcNAcase нацелен на митохондрии и регулирует уровень митохондриальных активных форм кислорода». Клетки . 11 (11): 1827. doi : 10.3390/cells11111827 . PMC 9180253 . PMID 35681522. S2CID 9180253.
- ^ Li J, Huang CL, Zhang LW, Lin L, Li ZH, Zhang FW, Wang P (июль 2010 г.). «Изоформы человеческого O-GlcNAcase демонстрируют различную каталитическую эффективность». Биохимия. Биохимия . 75 (7): 938– 43. doi :10.1134/S0006297910070175. PMID 20673219. S2CID 2414800.
- ^ Грейг, Ян; Вокадло, Дэвид. «Семейство гликозидгидролаз 84». Cazypedia . Получено 28 марта 2017 г.
- ^ Gao Y, Wells L, Comer FI, Parker GJ, Hart GW (март 2001 г.). «Динамическое O-гликозилирование ядерных и цитозольных белков: клонирование и характеристика нейтральной цитозольной бета-N-ацетилглюкозаминидазы из человеческого мозга». Журнал биологической химии . 276 (13): 9838– 45. doi : 10.1074/jbc.M010420200 . PMID 11148210.
- ^ Lima VV, Rigsby CS, Hardy DM, Webb RC, Tostes RC (2009). «O-GlcNAcylation: новый посттрансляционный механизм изменения сосудистой клеточной сигнализации в норме и патологии: фокус на гипертонии». Журнал Американского общества гипертонии . 3 (6): 374–87 . doi :10.1016/j.jash.2009.09.004. PMC 3022480. PMID 20409980 .
- ^ Förster S, Welleford AS, Triplett JC, Sultana R, Schmitz B, Butterfield DA (сентябрь 2014 г.). «Повышенные уровни O-GlcNAc коррелируют с пониженными уровнями O-GlcNAcase в мозге при болезни Альцгеймера». Biochimica et Biophysica Acta (BBA) - Молекулярные основы заболеваний . 1842 (9): 1333– 9. doi :10.1016/j.bbadis.2014.05.014. PMC 4140188. PMID 24859566 .
- ^ Shafi R, Iyer SP, Ellies LG, O'Donnell N, Marek KW, Chui D и др. (май 2000 г.). «Ген трансферазы O-GlcNAc находится на X-хромосоме и необходим для жизнеспособности эмбриональных стволовых клеток и онтогенеза мышей». Труды Национальной академии наук Соединенных Штатов Америки . 97 (11): 5735– 9. Bibcode : 2000PNAS ...97.5735S. doi : 10.1073/pnas.100471497 . PMC 18502. PMID 10801981.
- ^ Love DC, Ghosh S, Mondoux MA, Fukushige T, Wang P, Wilson MA и др. (апрель 2010 г.). «Динамическое циклирование O-GlcNAc в промоторах генов Caenorhabditis elegans, регулирующих долголетие, стресс и иммунитет». Труды Национальной академии наук Соединенных Штатов Америки . 107 (16): 7413– 8. Bibcode : 2010PNAS..107.7413L. doi : 10.1073/pnas.0911857107 . PMC 2867743. PMID 20368426 .
- ^ Dennis RJ, Taylor EJ, Macauley MS, Stubbs KA, Turkenburg JP, Hart SJ и др. (апрель 2006 г.). «Структура и механизм бактериальной бета-глюкозаминидазы с активностью O-GlcNAcase». Nature Structural & Molecular Biology . 13 (4): 365–71 . doi :10.1038/nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Alonso J, Schimpl M, van Aalten DM (декабрь 2014 г.). «O-GlcNAcase: беспорядочная гексозаминидаза или ключевой регулятор сигнализации O-GlcNAc?». Журнал биологической химии . 289 (50): 34433– 9. doi : 10.1074/jbc.R114.609198 . PMC 4263850. PMID 25336650 .
- ^ Ченг, Стивен С.; Моди, Элисон К.; Ву, Кристина М. (2024-11-07). «Возможности терапевтической модуляции O-GlcNAc». Chemical Reviews . doi :10.1021/acs.chemrev.4c00417. ISSN 0009-2665.
- ^ Lim S, Haque MM, Nam G, Ryoo N, Rhim H, Kim YK (август 2015 г.). «Мониторинг внутриклеточной агрегации тау, регулируемой ингибиторами OGA/OGT». International Journal of Molecular Sciences . 16 (9): 20212– 24. doi : 10.3390/ijms160920212 . PMC 4613198. PMID 26343633 .
- ^ Roth C, Chan S, Offen WA, Hemsworth GR, Willems LI, King DT и др. (июнь 2017 г.). «Структурное и функциональное понимание человеческого O-GlcNAcase». Nature Chemical Biology . 13 (6): 610– 612. doi :10.1038/nchembio.2358. PMC 5438047. PMID 28346405.
Дальнейшее чтение
- Накадзима Д., Оказаки Н., Ямакава Х., Кикуно Р., Охара О., Нагасе Т. (июнь 2002 г.). «Создание готовых к экспрессии клонов кДНК для генов KIAA: ручное курирование 330 клонов кДНК KIAA». Исследование ДНК . 9 (3): 99–106 . doi : 10.1093/dnares/9.3.99 . ПМИД 12168954.
- Ishikawa K, Nagase T, Suyama M, Miyajima N, Tanaka A, Kotani H и др. (июнь 1998 г.). «Предсказание кодирующих последовательностей неопознанных генов человека. X. Полные последовательности 100 новых клонов кДНК из мозга, которые могут кодировать большие белки in vitro». DNA Research . 5 (3): 169– 76. doi : 10.1093/dnares/5.3.169 . PMID 9734811.
- Gao Y, Wells L, Comer FI, Parker GJ, Hart GW (март 2001 г.). «Динамическое O-гликозилирование ядерных и цитозольных белков: клонирование и характеристика нейтральной цитозольной бета-N-ацетилглюкозаминидазы из человеческого мозга». Журнал биологической химии . 276 (13): 9838– 45. doi : 10.1074/jbc.M010420200 . PMID 11148210.
- Comtesse N, Maldener E, Meese E (май 2001 г.). «Идентификация ядерного варианта MGEA5, цитоплазматической гиалуронидазы и бета-N-ацетилглюкозаминидазы». Biochemical and Biophysical Research Communications . 283 (3): 634– 40. doi :10.1006/bbrc.2001.4815. PMID 11341771.
- Wells L, Gao Y, Mahoney JA, Vosseller K, Chen C, Rosen A, Hart GW (январь 2002 г.). «Динамическое O-гликозилирование ядерных и цитозольных белков: дальнейшая характеристика ядерно-цитоплазматической бета-N-ацетилглюкозаминидазы, O-GlcNAcase». Журнал биологической химии . 277 (3): 1755– 61. doi : 10.1074/jbc.M109656200 . PMID 11788610.
- Фарук В.С., Богардус К., Прохазка М. (2003). «Анализ MGEA5 на участке 10q24.1-q24.3, кодирующем бета-O-связанную N-ацетилглюкозаминидазу как ген-кандидат для сахарного диабета 2 типа у индейцев пима». Молекулярная генетика и метаболизм . 77 ( 1– 2): 189– 93. doi : 10.1016/S1096-7192(02)00127-0. PMID 12359146.
- Beausoleil SA, Jedrychowski M, Schwartz D, Elias JE, Villén J, Li J, et al. (Август 2004). "Крупномасштабная характеристика ядерных фосфопротеинов клеток HeLa". Труды Национальной академии наук Соединенных Штатов Америки . 101 (33): 12130– 5. Bibcode : 2004PNAS..10112130B. doi : 10.1073/pnas.0404720101 . PMC 514446. PMID 15302935 .
- Ballif BA, Villén J, Beausoleil SA, Schwartz D, Gygi SP (ноябрь 2004 г.). «Фосфопротеомный анализ развивающегося мозга мыши». Молекулярная и клеточная протеомика . 3 (11): 1093– 101. doi : 10.1074/mcp.M400085-MCP200 . PMID 15345747.
- Toleman C, Paterson AJ, Whisenhunt TR, Kudlow JE (декабрь 2004 г.). «Характеристика домена гистонацетилтрансферазы (HAT) бифункционального белка с активируемыми O-GlcNAcase и HAT-активностями». Журнал биологической химии . 279 (51): 53665– 73. doi : 10.1074/jbc.M410406200 . PMID 15485860.
- Whisenhunt TR, Yang X, Bowe DB, Paterson AJ, Van Tine BA, Kudlow JE (июнь 2006 г.). «Нарушение ферментного комплекса, регулирующего O-GlcNAcylation, блокирует сигнализацию и развитие». Glycobiology . 16 (6): 551– 63. doi : 10.1093/glycob/cwj096 . PMID 16505006.
- Toleman C, Paterson AJ, Kudlow JE (май 2006 г.). «Расположение и характеристика активного сайта O-GlcNAcase». Biochimica et Biophysica Acta (BBA) - General Subjects . 1760 (5): 829–39 . doi :10.1016/j.bbagen.2006.01.017. PMID 16517082.
- Cameron EA, Martinez-Marignac VL, Chan A, Valladares A, Simmonds LV, Wacher N и др. (2007). «Полиморфизм MGEA5-14 и диабет 2 типа в Мехико». American Journal of Human Biology . 19 (4): 593– 6. doi :10.1002/ajhb.20639. PMID 17546623. S2CID 13712358.
Внешние ссылки
- Protein+O-GlcNAcase в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)