Безумный2
| Компонент контрольной точки митотического веретена Mad2 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | Безумный2 | ||||||
| Альтернативные символы | YJL030W | ||||||
| Энтрез | 853422 | ||||||
| РефСек (мРНК) | NM_001181464 | ||||||
| RefSeq (Прот) | NP_012504 | ||||||
| UniProt | Р40958 | ||||||
| Другие данные | |||||||
| хромосома | X: 0,39 - 0,39 Мб | ||||||
| |||||||
Mad2 (дефицит митоза 2) является важным белком контрольной точки веретена . Система контрольной точки веретена является регуляторной системой, которая сдерживает прогрессирование через переход от метафазы к анафазе . Ген Mad2 был впервые идентифицирован в дрожжах S. cerevisiae при скрининге генов, которые при мутации придавали бы чувствительность к ядам микротрубочек . [1] Человеческие ортологи Mad2 ( MAD2L1 и MAD2L2 ) были впервые клонированы в поисках человеческих кДНК, которые бы спасали чувствительность к ядам микротрубочек штамма дрожжей, в котором отсутствовал белок, связывающий кинетохоры . [2] Было показано, что белок присутствует в неприкрепленных кинетохорах, и исследования ингибирования антител показали, что необходимо выполнить блокировку перехода от метафазы к анафазе в ответ на яд микротрубочек нокодазол . [2] Последующее клонирование ортолога Xenopus laevis , которому способствовало совместное использование человеческой последовательности, позволило охарактеризовать митотические контрольные точки в экстрактах яиц. [3]
Переход из метафазы в анафазу
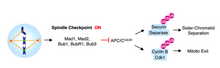
Переход от метафазы к анафазе отмечен разделением сестринских хроматид . Механизм контроля клеточного цикла , который предотвращает разделение сестринских хроматид и переход в анафазу, называется контрольной точкой веретена. В качестве защиты от ошибок сегрегации хромосом контрольная точка сборки веретена (SAC) задерживает анафазу до тех пор, пока все пары сестринских хроматид не станут биполярно соединенными.
После того, как микротрубочки прикрепляются к кинетохорам, хромосомы выравниваются на метафазной пластинке и достигается правильная биориентация, механизмы остановки SAC удаляются. Вход в анафазу опосредуется активацией APCCdc20. APCCdc20 представляет собой убиквитин-протеинлигазу, которая помечает белок, секурин, для разрушения. Разрушение секурина освобождает и активирует его связанного партнера протеазы, сепаразу. Сепараза, связанная с секурином, остается ингибированной; однако, когда ингибирование снимается, активированная сепараза расщепляет комплекс когезина, который связывает сестринские хроматиды вместе. [5]
Без Cdc20 комплекс, способствующий анафазе (APC), не может активироваться, и анафаза не запускается. Было показано, что Mad2 ингибирует активность APC путем прямого физического взаимодействия [6] в тройном комплексе с Cdc20. [7] Кинетохоры, которые остаются неприкрепленными к микротрубочкам, катализируют секвестрацию Cdc20 Mad2. Фактически, когда метафазные клетки млекопитающих обрабатываются веретено-деполимеризующим агентом нокодазолом, белки Mad2 локализуются на кинетохорах всех пар сестринских хроматид. [5]
Mad2 конформеры
![[4]](http://upload.wikimedia.org/wikipedia/commons/0/0b/Mad2conformers.png)
Mad2 способен образовывать мультимеры и принимает по крайней мере две структурные конформации . Открытый Mad2 отличается от закрытого Mad2 расположением 50 остатков C-концевого сегмента. Этот «ремень безопасности» плотно прилегает к правой стороне белка в открытой конформации. При ослаблении ремень безопасности может быть повторно размещен вокруг связывающего партнера. В закрытой конформации ремень безопасности оборачивается вокруг связанного лиганда и взаимодействует с другой областью Mad2. Связывающие партнеры Mad2 включают либо Cdc20, либо Mad1. Mad1 и Cdc20 связывают Mad2 идентичным образом. Mad2 использует один и тот же сайт для связывания либо Mad1 , либо Cdc20 и, таким образом, может связывать только один из двух белков одновременно. [5]
Активация Mad2 в контрольной точке сборки шпинделя

Поскольку неприкрепленные кинетохоры устанавливают и поддерживают SAC, Mad2 привлекается для предотвращения разделения этих невыровненных сестринских хроматид. Когда активируется процесс контрольной точки/торможения, Mad2 связывает Mad1, образуя комплексы Closed-Mad2-Mad1. Учитывая, что Mad1:Mad2 является стабильным комплексом, а Cdc20 и Mad1 связывают Mad 2 в одном и том же месте связывания, крайне маловероятно, что Closed Mad2 высвобождает Mad1 для связывания Cdc20.
Модель, которая объясняет, что Mad2 принимает конформацию, способную связывать Cdc20, основана на формировании комплекса ядра Mad1-Mad2 в первую очередь. В этой модели внешний Open Mad2 рекрутируется в шаблон Mad1:Mad2. Считается, что это взаимодействие Mad1:Mad2 обеспечивает конформационное изменение, которое позволяет периферически связанному Open Mad2 взаимодействовать с Cdc20. Затем Cdc20:Mad2 диссоциирует, и Mad1:Mad2 снова может связывать свободный цитозольный Mad2. [8]
Предполагается, что после формирования комплексы Cdc20:Mad2 могут усиливать сигнал ожидания анафазы, стимулируя дальнейшее преобразование цитозольного открытого Mad2 и свободного Cdc20 в большее количество комплексов Cdc20:Closed Mad2. Это диффузное распространение сигнала от комплексов кинетохора может объяснить, как вакансия всего лишь одного крошечного участка кинетохора может полностью остановить переход метафазы в анафазу. [9]
Будущая работа
Многое еще предстоит объяснить относительно сигналов контрольной точки веретена и вклада других белков сборки контрольной точки веретена, таких как Bub1 , BubR1 и Bub3 . BubR1 и Bub3 также могут образовывать комплексы с Cdc20, но еще предстоит выяснить, способствуют ли эти белки связыванию Cdc20 с Open Mad2. [9]
Также неясно, как p31comet противодействует контрольной точке и способствует диссоциации Mad2-Cdc20. Де Антони и др. в сочетании с «Mad2 Template» предполагают, что p31comet конкурирует с Open Mad2 за связывание с Closed Mad2:Mad1. В настоящее время проводятся испытания с целью выяснить, как p31comet может заглушить контрольную точку веретена. [10]
Ссылки
- ^ Ли Р., Мюррей AW (1991). "Контроль обратной связи митоза у почкующихся дрожжей". Cell . 66 (3): 519– 31. doi :10.1016/0092-8674(81)90015-5. PMID 1651172. S2CID 11306198.
- ^ ab Li Y, Benezra R (1996). «Идентификация гена контрольной точки митоза человека: hsMAD2». Science . 274 (5285): 246– 8. Bibcode :1996Sci...274..246L. doi :10.1126/science.274.5285.246. PMID 8824189. S2CID 41334564.
- ^ Chen RH, Waters JC, Salmon ED, Murray AW (октябрь 1996 г.). "Связь компонента контрольной точки сборки веретена XMAD2 с неприсоединенными кинетохорами". Science . 274 (5285): 242– 6. Bibcode :1996Sci...274..242C. doi :10.1126/science.274.5285.242. PMID 8824188. S2CID 20142555.
- ^ ab Yu H (апрель 2006 г.). «Структурная активация Mad2 в контрольной точке митотического веретена: модель Mad2 с двумя состояниями в сравнении с моделью шаблона Mad2». J. Cell Biol . 173 (2): 153–7 . doi :10.1083/jcb.200601172. PMC 2063805. PMID 16636141 .
- ^ abc Morgan DL (2007). Клеточный цикл: принципы управления . Лондон: Опубликовано New Science Press совместно с Oxford University Press. ISBN 978-0-87893-508-6.
- ^ Li Y, Gorbea C, Mahaffey D, Rechsteiner M, Benezra R (ноябрь 1997 г.). "MAD2 ассоциируется с комплексом, способствующим циклосоме/анафазе, и подавляет его активность". Proc. Natl. Acad. Sci. USA . 94 (23): 12431– 6. Bibcode :1997PNAS...9412431L. doi : 10.1073/pnas.94.23.12431 . PMC 24983 . PMID 9356466.
- ^ Вассманн К, Бенезра Р (сентябрь 1998 г.). «Mad2 временно ассоциируется с комплексом APC/p55Cdc во время митоза». Proc. Natl. Acad. Sci. USA . 95 (19): 11193– 8. Bibcode :1998PNAS...9511193W. doi : 10.1073/pnas.95.19.11193 . PMC 21618 . PMID 9736712.
- ^ Hardwick KG (февраль 2005 г.). «Передача сигналов контрольной точки: конформеры Mad2 и распространение сигнала». Curr. Biol . 15 (4): R122–4. doi : 10.1016/j.cub.2005.02.008 . PMID 15723780.
- ^ ab Nasmyth K (март 2005 г.). «Как столь немногие контролируют столь многих?». Cell . 120 (6): 739– 46. doi : 10.1016/j.cell.2005.03.006 . PMID 15797376.
- ^ Де Антони А., Пирсон К.Г., Чимини Д., Канман Дж.К., Сала В., Нези Л., Мапелли М., Сирони Л., Фаретта М., Салмон Э.Д., Мусаккио А. (февраль 2005 г.). «Комплекс Mad1/Mad2 как шаблон активации Mad2 в контрольной точке шпиндельной сборки». Курс. Биол . 15 (3): 214–25 . doi : 10.1016/j.cub.2005.01.038 . PMID 15694304. S2CID 3224122.