Живая медицина
.pdf/page1-440px-Probiotic-associated_therapeutic_curli_hybrids_(PATCH).pdf.jpg)
Живое лекарство — это тип биологического препарата , который состоит из живого организма, используемого для лечения болезни. Обычно это клетка (животного, бактериального или грибкового) или вирус, который был генетически модифицирован для обладания терапевтическими свойствами, и который вводится пациенту. [2] [3] Возможно, старейшим применением живого лекарства является использование пиявок для кровопускания , хотя с тех пор живые лекарства значительно продвинулись вперед.
Примерами живых лекарств являются клеточная терапия (включая иммунотерапию ), фаговая терапия и бактериальная терапия , подклассом которой являются пробиотики .
Разработка живых лекарств


Разработка живых лекарств является чрезвычайно активной областью исследований в области синтетической биологии и микробиологии . [6] [7] [8] [9] [10] [11] [12] [13] [14] В настоящее время большое внимание уделяется: 1) выявлению микробов, которые естественным образом оказывают терапевтические эффекты (например, пробиотические бактерии), и 2) генетическому программированию организмов для оказания терапевтических эффектов. [15] [16] [17]
Приложения
Терапия рака
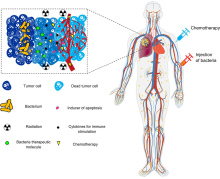
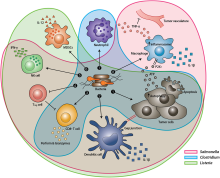

Существует огромный интерес к использованию бактерий в качестве терапии для лечения опухолей. В частности, бактерии, направляющиеся в опухоль и процветающие в гипоксической среде, особенно привлекательны для этой цели, поскольку они будут иметь тенденцию мигрировать, вторгаться (через протекающую сосудистую сеть в микросреде опухоли ) и колонизировать опухоли. Это свойство имеет тенденцию увеличивать время их пребывания в опухоли, давая им больше времени для проявления своего терапевтического эффекта, в отличие от других бактерий, которые быстро очищаются иммунной системой. [19] [20] [21] [22]
Ссылки
- ^ В данной статье использован текст Пичета Правесхотинунта, Анны М. Дурай-Татте, Ильи Гельфата, Франциски Баль, Дэвида Б. Чоу и Нила С. Джоши, доступный по лицензии CC BY 4.0.
- ^ Сэмпл, Иэн (16 января 2019 г.). «Живая медицина помогает сделать прорыв в борьбе с токсичным аммиаком». The Guardian . Получено 5 апреля 2020 г. .
- ^ «Разработка живых лекарств для лечения хронических заболеваний | SBE | Общество биологической инженерии». www.aiche.org .
- ^ В данной статье использован текст Марка Р. Шарбонно, Винсента М. Изабеллы, Нинга Ли и Кэролайн Б. Курц, доступный по лицензии CC BY 4.0.
- ^ В данной статье использован текст Марка Р. Шарбонно, Винсента М. Изабеллы, Нинга Ли и Кэролайн Б. Курц, доступный по лицензии CC BY 4.0.
- ^ Вебер, Вильфрид; Фуссенеггер, Мартин (январь 2012 г.). «Новые биомедицинские приложения синтетической биологии». Nature Reviews Genetics . 13 (1): 21– 35. doi :10.1038/nrg3094. ISSN 1471-0056. PMC 7097403. PMID 22124480 .
- ^ Фишбах, MA; Блюстоун, JA; Лим, WA (2013-04-03). «Клеточная терапия: следующий столп медицины». Science Translational Medicine . 5 (179): 179ps7. doi :10.1126/scitranslmed.3005568. ISSN 1946-6234. PMC 3772767. PMID 23552369 .
- ^ Китада, Тасуку; ДиАндрет, Брианна; Тиг, Брайан; Вайс, Рон (2018-02-09). «Программирование генной и клеточной терапии с помощью синтетической биологии». Science . 359 (6376): eaad1067. doi : 10.1126/science.aad1067 . ISSN 0036-8075. PMC 7643872 . PMID 29439214.
- ^ Маккарти, Нико (18 декабря 2018 г.). «Почему 2018 год стал годом «живой» медицины». Medium . Получено 5 апреля 2020 г. .
- ^ Келли, Джейсон (12 июня 2019 г.). «Эра живых лекарств». Ginkgo Bioworks . Получено 5 апреля 2020 г.
- ^ Service18 февраля, Роберт Ф. (18 февраля 2020 г.). «От «живого» цемента до биопленок, доставляющих лекарства, биологи переделывают материальный мир». AAAS . Получено 5 апреля 2020 г. .
{{cite news}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Курц, Каролин Б.; Милле, Ив А.; Пуурунен, Марья К.; Перро, Милен; Шарбонно, Марк Р.; Изабелла, Винсент М.; Котула, Джонатан В.; Антипов, Юджин; Дагон, Йосси; Денни, Уильям С.; Вагнер, Дэвид А. (16.01.2019). «Сконструированная E. coli Nissle улучшает гипераммониемию и выживаемость у мышей и демонстрирует дозозависимое воздействие на здоровых людей». Science Translational Medicine . 11 (475): eaau7975. doi : 10.1126/scitranslmed.aau7975 . ISSN 1946-6234. PMID 30651324. S2CID 58031579.
- ^ Шарбонно, Марк Р.; Изабелла, Винсент М.; Ли, Нин; Курц, Кэролайн Б. (2020-04-08). «Разработка нового класса инженерных живых бактериальных терапевтических средств для лечения заболеваний человека». Nature Communications . 11 (1): 1738. Bibcode : 2020NatCo..11.1738C. doi : 10.1038/s41467-020-15508-1 . ISSN 2041-1723. PMC 7142098. PMID 32269218 .
- ^ "Генные схемы расширяют возможности клеточной и генной терапии следующего поколения". GEN - Новости генной инженерии и биотехнологии . 1 февраля 2020 г. Получено 5 апреля 2020 г.
- ^ «Почему сейчас самое время для программируемых живых лекарств: идеи Джима Коллинза, Аойфы Бреннан и Джейсона Келли». SynBioBeta . 2 апреля 2019 г. Получено 5 апреля 2020 г.
- ^ Коста, Кевин (20 февраля 2019 г.). «Живые лекарства: машина Гинкго, способная разрушить фармацевтическую промышленность». SynBioBeta . Получено 5 апреля 2020 г.
- ^ Гурбатри, Кэндис Р.; Арпайя, Николас; Данино, Тал (25 ноября 2022 г.). «Инженерные бактерии как интерактивные методы лечения рака». Science . 378 (6622): 858– 864. Bibcode :2022Sci...378..858G. doi :10.1126/science.add9667. PMC 10584033 . PMID 36423303. S2CID 253839557.
- ^ В данной статье использован текст Май Ти-Куинь Дуонг, Йешан Цинь, Сон-Хван Ю и Чон-Джун Мин, доступный по лицензии CC BY 4.0.
- ^ Sieow, Brendan Fu-Long; Wun, Kwok Soon; Yong, Wei Peng; Hwang, In Young; Chang, Matthew Wook (декабрь 2020 г.). «Изменение метода лечения: перепрограммирование бактерий для лечения рака». Trends in Cancer . 7 (5): 447– 464. doi : 10.1016/j.trecan.2020.11.004 . ISSN 2405-8033. PMID 33303401.
- ^ Duong, Mai Thi-Quynh; Qin, Yeshan; You, Sung-Hwan; Min, Jung-Joon (2019-12-11). «Взаимодействие бактерий и рака: терапия рака на основе бактерий». Experimental & Molecular Medicine . 51 (12): 1– 15. doi :10.1038/s12276-019-0297-0. ISSN 2092-6413. PMC 6906302. PMID 31827064 .
- ^ Седиги, Мансур; Захеди Биалваи, Абед; Хэмблин, Майкл Р.; Охади, Эльназ; Асади, Арезу; Халаджзаде, Масуме; Лохрасби, Вахид; Мохаммадзаде, Нима; Амириани, Таги; Крутова, Марсела; Амини, Абольфазл (05 апреля 2019 г.). «Терапевтические бактерии для борьбы с раком; текущие достижения, проблемы и возможности». Раковая медицина . 8 (6): 3167–3181 . doi :10.1002/cam4.2148. ISSN 2045-7634. ПМК 6558487 . ПМИД 30950210.
- ^ Сонг, Шиюй; Вуай, Миза С.; Чжун, Минтао (2018-03-15). «Роль бактерий в терапии рака – враги в прошлом, но союзники в настоящем». Инфекционные агенты и рак . 13 (1): 9. doi : 10.1186/s13027-018-0180-y . ISSN 1750-9378. PMC 5856380. PMID 29568324 .