Список прекурсоров для химического осаждения из паровой фазы на основе металлоорганических соединений
В химии прекурсор — это соединение, которое участвует в химической реакции и производит другое соединение или химическое вещество, которое дает начало другому более значимому химическому продукту. Уже несколько лет металлоорганические соединения широко используются в качестве молекулярных прекурсоров для процесса химического осаждения из паровой фазы (MOCVD). Успех этого метода в основном обусловлен его адаптивностью и растущим интересом к процессам низкотемпературного осаждения. Соответственно, растущий спрос на различные тонкопленочные материалы для новых промышленных применений также является важной причиной быстрого развития MOCVD. Конечно, широкий спектр материалов, которые не могли быть осаждены с помощью обычного процесса галогенидного CVD, поскольку галогенидные реактивы не существуют или не являются летучими, теперь можно выращивать с помощью MOCVD. Сюда входят металлы и различные многокомпонентные материалы, такие как полупроводниковые и интерметаллические соединения, а также карбиды, нитриды, оксиды, бориды, силициды и халькогениды. Другими значительными преимуществами MOCVD по сравнению с физическими процессами являются возможность крупномасштабного производства, более простая автоматизация, хорошее конформное покрытие, селективность и способность производить метастабильные материалы. [1]
Таким образом, много усилий было направлено на синтез новых молекулярных прекурсоров. Продуктивный обзор представлен несколькими исключительными обзорами, охватывающими такие области MOCVD, как, например, эпитаксиальный рост полупроводниковых соединений, [2] [3] [4] и низкотемпературное осаждение металлов. [5] [6] Обзор металлоорганических соединений, используемых для роста MOCVD различных видов материалов, представлен в следующих обзорах. [7] [8] [9] Это список известных комплексов-прекурсоров, синтезированных к настоящему времени, с подходящими свойствами для использования в процессах MOCVD.
Список
| Предшественник, название, формула | Номер CAS | Химическая стабильность | Температурная стабильность | Испарение T (давление) | Давление пара (oC/Торр) | Разложение Т | Олигомеризация | Кристаллическая структура | Температура плавления | Данные ТГ | ДСК | ИК-спектры | Данные ЯМР | Растворимость | Ссылки |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li ( TMHD), тетраметилгептандионат лития , C11H19LiO2 | 22441-13-0 | Разлагается при низком давлении и комнатной температуре, [1] стабилен в атмосфере N2 или Ar в герметичном контейнере, медленно разлагается при контакте с влажным воздухом и быстро при контакте с водой. | Выше 215 °C в условиях высокого вакуума разлагается с образованием кетенов и карбанионов [1] | 268-270 °C (атмосферное давление) | NA | 265-268 °С | Растворим в воде | [1] Д. Саулис, В. Джошкин, М. Худяков, Т.Ф. Куеч, А.Б. Эллис, С.Р. Октябрьский, Л. МакКоган, Journal of Crystal Growth 217 (2000) 287-301. | |||||||
| Бис(триметилсилил)амид лития , LiN(SiMe 3 ) 2 | 4039- | Бурно реагирует с водой. | 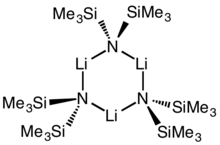 | 70-72 °С | Й. Хамалайнен, Й. Холопайнен, Ф. Мунник, Т. Хатанпаа, М. Хейккила, М. Ритала и М. Лескела, J Electrochem Soc, 159, A259 (2012). | ||||||||||
| Литий бис(этилдиметилсилил)амид, [Li(NSiMe2Et) 2 ] 2 | 300585-49-3 | 122/0,2 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | ||||||||||||
| Трет-амил(и-пропилдиметилсилил)амид лития | 137/0,2 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Литий бис(3,3-диметилбутилдиметилсилил)амид | 225/0,9 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Трет-амил(изобутилдиметилсилил)амид лития | 145/0,1 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Трет-амил(н-пропилдиметилсилил)амид лития | 171/0.3 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Литий бис(н-пропилдиметилсилил)амид | 130/0,15 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Литий бис(изобутилдиметилсилил)амид | 145/0,05 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Трет-амил(триэтилсилил)амид лития | 157/0,095 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Литий бис(н-бутилдиметилсилил)амид | 145/0,085 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Диметиламид лития, (CH 3 ) 2 NLi | 3585-33-9 | Самопроизвольно загорается при контакте с воздухом и водой, выделяя горючий газ. | https://pubchem.ncbi.nlm.nih.gov/compound/Литий-диметиламид | ||||||||||||
| Дициклогексиламидолитий , C12H24Li2N | 4111-55-1 | Высокая температура сублимации 250 °C, при которой также происходит частичное термическое разложение. | 250 °С | Путконен М., Аалтонен Т., Алнес М., Саджаваара Т., Нильсен О. и Фьеллвог Х., Journal of Materials Chemistry, 2009, 19(46), 8767 | |||||||||||
| Li ( acac), ацетилацетонат лития , C5H7LiO2 | 18115-70-3 | Гигроскопичен | Аэрозоль [1] | 250 °С | Метанол | [1] В. Борнан, Ф. Папет, Э. Филиппо, Тонкие твердые пленки, 1997, 304, 239. | |||||||||
| Этилат лития , LiC2H5O | 2388-07-0 | Самонагревается и бурно реагирует с водой. | Разлагается при 325 °C. LiOEt нерастворим в углеводородах, растворим в EtOH (125 г/л), α = 6,4 (МС), ΔHform = -108,6 | Порошок сублимируется при 100 °C/вакуум, 150 °C/10-2 торр. | https://www.sigmaaldrich.com/catalog/product/aldrich/400203?lang=en | ||||||||||
| Изопропоксид лития C3H7LiO | 2388-10-5 | «Чувствителен к влаге и реагирует с водой. Материал медленно разлагается при контакте с влажным воздухом и быстро при контакте с водой, возможно возгорание. Избегайте контакта с влажным воздухом, водой, кислотами, спиртами, кетонами, эфирами, углекислым газом, галогенами». | Легко воспламеняется, стабилен в среде азота или аргона в герметичных контейнерах. |  | https://pubchem.ncbi.nlm.nih.gov/compound/Lithium-isopropoxy#section=Chemical-and-Physical-Properties | ||||||||||
| [Li(OtBu)]6, трет - бутоксид лития , C4H9LiO | 1907-33-1 | Устойчив к воздействию света, тепла, воздуха, углекислого газа и сильных кислот. Чувствителен к влаге, бурно реагирует на воду. | 108-115 °С [1,2] | 283 °С | Растворим в толуоле, гексане, тетрагидрофуране и метил-трет-бутиловом эфире. | [1] А. Дабирян, Ю. Кузьминых, С. С. Санду, С. Харада, Э. Вагнер, П. Бродар, Г. Бенвенути, С. Рашворт, П. Муральт, П. Хоффманн, Cryst. Growth Des. 2011, 1, 203. [2] А. Танака, К. Мияшита, Т. Таширо, М. Кимура, Т. Sukegawa, J. Cryst. 1995, 148, 324. [3] Дж. Хамалайнен, Дж. Холопайнен, Ф. Мунник, Т. Хатанпаа, М. Хейккила, М. Ритала и М. Лескела, J Electrochem Soc, 159. , А259 (2012). [4] Сигма-Альдтрич». | |||||||||
| Лита(OEt) 6 | 127503-04-2 | Двойные алкоксиды имеют достаточную стабильность при использовании исходного спирта в качестве растворителя. Разлагается при контакте с водой. | Термическая стабильность и летучесть различаются в зависимости от реакции в твердом или жидком состоянии. | 230/0,2 | https://www.chemicalbook.com/ChemicalProductProperty_EN_CB2739827.htm | ||||||||||
| гексаизопропокситанталат лития LiTa(i-OPr) 6 | 160-180/0,1 | https://www.tms.org/pubs/journals/JOM/9710/Xu/Xu-9710.html | |||||||||||||
| LiTa(t-OBut) 6 | 110-120/0,1 | https://www.tms.org/pubs/journals/JOM/9710/Xu/Xu-9710.html | |||||||||||||
| Этилат лития-ниобия, LiNb(OC 2 H 5 ) 6 | Чувствителен к влаге | Suyama, Y., Yamada, T., Hirano, Y., Takamura, K., & Takahashi, K. (2010). Новый процесс синтеза ниобатов Li, Na и K из алкоксидов металлов. Достижения в науке и технике, 63, 7–13. doi :10.4028/www.scientific.net/ast.63.7 | |||||||||||||
| LiNb(i-OPr) 6 | <140/0,2 | https://www.tms.org/pubs/journals/JOM/9710/Xu/Xu-9710.html | |||||||||||||
| LiNb(t-OBut) 6 | 110-120/0,1 | https://www.tms.org/pubs/journals/JOM/9710/Xu/Xu-9710.html | |||||||||||||
| Этилат натрия ниобия, NaNb(OC 2 H 5 ) 6 | Чувствителен к влаге | Suyama, Y., Yamada, T., Hirano, Y., Takamura, K., & Takahashi, K. (2010). Новый процесс синтеза ниобатов Li, Na и K из алкоксидов металлов. Достижения в науке и технике, 63, 7–13. doi :10.4028/www.scientific.net/ast.63.7 | |||||||||||||
| Циклопентадиенид натрия , C5H5Na | 4984-82-1 | При контакте с водой выделяет легковоспламеняющиеся газы, которые могут самопроизвольно воспламениться. | Растворим в ТГФ, бензоле или жидком NH 3 | «1. (a) Фишер Э.О.; Йира Р.; Хафнер К.З. Naturforsch. 1953, 8b; (b) Фишер Э.О.; Хафнер В.; Шталь ХОЗ Anorg. Allg. Chem.1955, 282, 47. 2. Фельхаммер, В.П. Херрманн, В.А. Офеле, К. В области синтеза; Методы металлоорганической и неорганической химии; Херрманн, В.А., Брауэр, Г., Ред.; Тиме: Штутгарт, 1997, том 3, стр. 50. 3. https://spectrabase.com/spectrum/IMGzWBmNgJE. 4.https://pubchem.ncbi.nlm.nih.gov/compound/Sodium-cyclopentadienide#section=GHS-Classification" | |||||||||||
| Гексафторацетилацетонат натрия, NaC 5 HF 6 O 2 | 22466-49-5 | 25/10.3 |  | 230 °С | Растворим в воде и теплом метоксипропаноле. | 1. Ж. Неорг. Хим. 41, 411 (1996). 2. Рек. Трав. Хим. 114, 242, (1995) | |||||||||
| 2,2,6,6-тетраметилгептан-3,5-дионат натрия, Na(thd) | 22466-43-9 | Возгоняется при температуре от 170 до 255 °C. |  | М. Тиитта, М. Лескала, Э. Нюканен, П. Сойнен, Л. Ниинстё, Thermochim. акта, 1995, 256 (1), 47-53 | |||||||||||
| Натрий 2,2,6,6-тетраметилгептан-3,5-дионат фенантролин, Na(thd)(phen) | Возгоняется при температуре около 210 °C | Д. Цымбаренко, И. Корсаков, А. Манкевич, Г. Гиричев, Е. Пелевина, А. Кауль, ECS Trans., 2009, т.25, Вып.8, 633-638 | |||||||||||||
| Натрий 2,2,6,6-тетраметилгептан-3,5-дионат 2,2'-бипиридин, Na(thd)(bipy) | Разлагается в 2 этапа, а именно около 90 °C и 140 °C. | Д. Цымбаренко, И. Корсаков, А. Манкевич, Г. Гиричев, Е. Пелевина, А. Кауль, ECS Trans., 2009, т.25, Вып.8, 633-638 | |||||||||||||
| Натрий-ниобий гексакис(изопропоксид), NaNb(OiPr) 6 | 110-120/0,1 | ||||||||||||||
| Бис(н-пропилдиметилсилил)амид натрия | 213/0.3 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Бис(изобутилдиметилсилил)амид натрия | 189/0,08 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Бис(н-бутилдиметилсилил)амид натрия | 231/0,5 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Бис(н-гексилдиметилсил)амид натрия | 265/0.3 | Брумхолл-Диллард, РНР, Гордон, Р.Г., и Вагнер, Вирджиния, Труды MRS, 1999, 606 | |||||||||||||
| Трет-бутоксид натрия, NaOC(CH 3 ) 3 | 865-48-5 | Стабилен при комнатной температуре. Разлагается при 300 °C; стабилен в атмосфере N2 или Ar в герметичном контейнере и медленно разлагается при контакте с влажным воздухом и бурно при контакте с водой. [1] | При 300 °С [1] | сублимация: 254 °C [2] (атмосферное давление) | Информация недоступна. | Информация недоступна. | 263 °С [3] | "• 30 г/л при 20 °C Среда: трет-бутиловый спирт • 70 г/л при 20 °C Среда: толуол • 130 г/л при 20 °C Среда: гексан • 380 г/л при 20 °C Среда: тетрагидрофуран • 50 г/л при 20 °C Среда: ксилол • 110 г/л при 20 °C Среда: октан • 220 г/л при 20 °C Среда: диэтиловый эфир • 450 г/л при 20 °C Среда: диметилформамид | ": [1] https://www.nwmissouri.edu/naturalsciences/sds/s/Sodium%20tert-butoxide.pdf: [2] https://www.albemarle.com/storage/components/T401225.PDF: [3] Симоне Манзини, Нурия Угет, Оливер Трапп, Рокко А. Пачьелло, Томас Шауб; «Синтез акрилатов из олефинов и CO2 с использованием алкоголятов натрия в качестве оснований» Catalysis Today, том 281, часть 2, 2017 г., страницы 379–386, ISSN 0920-5861 | ||||||
| Калий-ниобий гексакис(этоксид), KNb(OEt) 6 | 200/0,8 | Suyama, Y., Yamada, T., Hirano, Y., Takamura, K., & Takahashi, K. (2010). Новый процесс синтеза ниобатов Li, Na и K из алкоксидов металлов. Достижения в науке и технике, 63, 7–13. doi :10.4028/www.scientific.net/ast.63.7 | |||||||||||||
| Трет - бутоксид калия ( KOtBu ) C4H9KO | 865-47-4 | Возгоняется при температуре 220 °C при давлении 1 Торр [1] | NA | 220/1 | 256 °С-258 °С [2] | Растворим в гексане, толуоле, диэтиловом эфире и тетрагидрофуране. | [1] Фейер и др. Журнал Американского химического общества, 1956, т. 78, стр. 4364, 4367 [2] https://www.sigmaaldrich.com/catalog/product/aldrich/156671?lang=de®ion=DE [3] Лаббоу Р., Михалик Д., Рейсс Ф., Шульц А. и Виллинджер , А., 2016. Выделение лабильных псевдогалогенных форм НСО. Angewandte Chemie International Edition, 55 (27), стр. 7680–7684. | ||||||||
| Калий 2,2,6,6-тетраметилгептан-3,5-дионат, K(thd), K(tmhd), K(dpm), C11H19KO2 | 22441-14-1 | Гигроскопичен |  | 195 °С | 1. Оноэ, А., Тасаки, И. и Чикума, К. (2005). Аномальные характеристики испарения стеклованного K(DPM) и стабильная подача газа с использованием дискообразных прекурсоров K(DPM) для химического осаждения из паров металлоорганических соединений. Журнал по росту кристаллов, 277(1-4), 546–554. doi :10.1016/j.jcrysgro.2005.01.077 2. www.molbase.com | ||||||||||
| Калий 2,2,6,6-тетраметилгептан-3,5-дионат фенантролин, K(thd)(phen) | 320-330 °С | Олигомеризуется с n до 7 | Д. Цымбаренко, И. Корсаков, А. Манкевич, Г. Гиричев, Е. Пелевина, А. Кауль, ECS Trans., 2009, т.25, Вып.8, 633-638 | ||||||||||||
| Би(фенил)3,Трифенилвисмут(III), (C 6 H 5 ) 3 Bi | 603-33-8 | Нет особых условий хранения | 76-80 °С | [1] Сигма | |||||||||||
| Fe ( tmhd)3, Трис (2,2,6,6 - тетраметил-3,5-гептандионато)железо( III ), Fe( C11H19O2 ) 3 | 14876-47-2 |  | 164 °С (Атм) (СТРЕМ); 179-185 °С (лит.) (Сигма) | [1] Сигма [2] Стрем | |||||||||||
| Ni(hfa)2tмеда | Испарение происходит в диапазоне температур 120–200 _C, с остатком около 2% при 350 _C (атм. в атмосфере N2)" | 120–200 °C (атм. давление под N2) | 106,7°С | [3] Серджио Баттиато, Мария М. Джангрегорио, Мария Р. Каталано, Рафаэлла Ло Нигро, Мария Лосурдо и Грациелла Маландрино; РСК Адв., 2016, 6, 30813–30823 | |||||||||||
| Ни(тта)2тмеда | количественно испаряется в диапазоне 200–330 _C, с остатком менее 2% при 350_°C. (Атм в атмосфере N2) | 2774(2) A˚ 3, Z = 4, Dc = 1,478 г см−3 | 147–149°С | просить | просить | [3] Серджио Баттиато, Мария М. Джангрегорио, Мария Р. Каталано, Рафаэлла Ло Нигро, Мария Лосурдо и Грациелла Маландрино; РСК Адв., 2016, 6, 30813–30823 | |||||||||
| Ni(tmhd)2,никель(II)-бис(2,2,6,6-тетраметил-3,5-гептандионат), Ni(OCC(CH 3 ) 3 CHCOC(CH 3 ) 3 ) 2 | 14481-08-4 | 219-223°С (Атм) | Мария Лосурдо и Грациелла Маландрино; RSC Adv., 2016, 6, 30813–30823 [4] Маландрино, Грациелла и М.С. Пердикаро, Лаура и Кондорелли, Джузеппе и Фрагала, Игнацио и Росси, Патриция и Даппорто, Паоло. (2006). Транзакции Далтона (Кембридж, Англия: 2003 г.). 8. 1101-6. 10.1039/б511317б. | ||||||||||||
| Ni(acac)2, ацетилацетонат никеля(II), Ni(C 5 H7O 2 ) 2 | 3264-82-2 | 230 - 240°С | эфиры и ароматические и галогенированные углеводороды | [1] СИГМА [4] Маландрино, Грациелла и М.С. Пердикаро, Лаура и Кондорелли, Джузеппе и Фрагала, Игнацио и Росси, Патриция и Даппорто, Паоло. (2006). Транзакции Далтона (Кембридж, Англия: 2003 г.). 8. 1101-6. 10.1039/б511317б. [6] А. Панде, Synlett, 2005, 6, 1042–1043. | |||||||||||
| La(hfa)3диглим | негигроскопичен, может транспортироваться на воздухе | "ТГА, 10 ""Clmin в атмосфере N2) показывают, что процессы сублимации происходят в диапазоне 115-295°C (остаток = 2% до 300°C)" | 74-76 °С | Этанол, хлороформ, ацетон, пентан, толуол и слабо растворим в циклогексане. | [7] Грациелла Маландрино, Розалия Ликата, Франческо Кастелли, Игнацио Л. Фрагала и Кристиано Бенелли. Неорганическая химия, 1995, 34 (25), 6233-6234». | ||||||||||
| Nb(THD)4, тетракис(2,2,6,6-тетраметилгептан-3,5- дионат ) ниобия , C44H76NbO8 | 41706-15-4 | Устойчив к воздействию воздуха и влаги, нерастворим в воде. | При атмосферном давлении и инертной атмосфере Li(thd) полностью испаряется до ≈270 °C без разложения. Нагревание Nb(thd)4 при аналогичных В результате получается твердый остаток ≈7%, что показывает, что испарение и разложение этого соединения происходят одновременно (полное разложение Nb(thd)4 до Nb2O5 должно оставить 16,1% остатка). [1] | 219-220 °С | 1,2-диметоксиэтан | [1] С. Маргерон, А. Бартасайт, В. Плаузинайтиен, А. Абрутис, П. Буле, В. Кубилюс, З. Салтайт, Proc. ШПИЕ 2013, 8626, 862612. | |||||||||
| Nb (thd)2Cl3 , Бис-дипивалоилметанат ниобия N - хлорид , C4H10Cl3NbO2 | 110615-13-9 | Чувствителен к воздуху. Легко гидролизуется. | 170 °С [1] | 230 °С | [1] S. Jung, N. Imaish, Korean, J. Chem. Eng. 1999, 16, 229. [2] Sigma-Aldritch | ||||||||||
| Ниобий пентакис(метоксид), Nb(OMe) 5 | Низкая волатильность | 200 °С [1] | [1] BJ Curtis, HR Brunner, Mater. Res. Bull. 1975, 10, 515. | ||||||||||||
| Nb(OEt) 5 , Пентаэтоксид ниобия, C 10 H 25 NbO 5 | 3236-82-6 | Чувствителен к воздуху и влаге. Несовместим с сильными кислотами и сильными окислителями. | 135-145 °С [1] 100-120 °С [2] | 5-6 °С | Сухой толуол, этанол. | [1] Ю. Сакашита, Х. Сегава, J. Appl. Физ. 1995, 77, 5995 [2] Ю. Акияма, К. Ситанака, Х. Мураками, Ю. С. Шин, М. Ёсида, Н. Имаиси, Тонкие твердые пленки. 2007, 515, 4975. [3] Сигма-Олдрич | |||||||||
| Этилат ниобия, Nb(OCH 2 CH 3 ) 5 | 3236-82-6 | Стабилен при комнатной температуре. Стабилен в условиях N2 или Ar в герметичном контейнере и быстро разлагается при контакте с влажным воздухом. Реагирует с водой. [1] | При 325-350 °С [2] | Информация недоступна. | 21,5 кПа при 500 К [3] | При 325-350 °С [2] | Димер | При 5 °С [4] | Растворим в органических растворителях. Разлагается в воде.Смешивается с органическими растворителями [4] | : [1] https://www.gelest.com/wp-content/uploads/product_msds/AKN590-msds.pdf: [2] Рахту, Антти (2002). Атомно-слоевое осаждение оксидов с высокой диэлектрической проницаемостью: рост пленки и исследования in situ (диссертация). Хельсинкский университет. ISBN 952-10-0646-3 : [3] Этилоксид ниобия (V) : [4] Цай Я-нань, Ян Шэн-хай, Цзинь Шэн-мин, Ян Хай-пин, Хоу Го-фэн, Ся Цзяо-юнь, "Электрохимический синтез, характеристика и термические свойства этилата ниобия"; J. Cent. South Univ. Technol. (2011) 18:73−77: [5] https://www.chemicalbook.com/ChemicalProductProperty_EN_CB3759592.htm | |||||
| Пентакис(диметиламино)тантал(V), Ta(N(CH 3 ) 2 ) 5 | 19824-59-0 | Бурно реагирует с водой. |  | 100 о С | https://www.sigmaaldrich.com/catalog/product/aldrich/496863?lang=en | ||||||||||
| Этоксид тантала(V), Ta(OC 2 H 5 ) 5 | 6074-84-6 | 21 о С | https://www.sigmaaldrich.com/catalog/product/aldrich/760404?lang=en | ||||||||||||
| Трис(диэтиламидо)(трет-бутилимидо)тантал(V), (CH 3 ) 3 CNTa(N(C 2 H 5 ) 2 ) 3 | 169896-41-7 | Бурно реагирует с водой. |  | https://www.sigmaaldrich.com/catalog/product/aldrich/521280?lang=en | |||||||||||
| Трис (этилметиламидо)(трет-бутилимидо)тантал ( V ) , C13H33N4Ta | 511292-99-2 | Бурно реагирует с водой. |  | https://www.sigmaaldrich.com/catalog/product/aldrich/j100043?lang=en | |||||||||||
| Цезий-иттрий тетракис (1,1,1-трифтор-5,5-диметилгексан-2,4-дионат) C32H40O8F12CsY | Викулова Е.С., Жерикова К.В., Зеленина Л.Н., Трубин С.В., Сысоев С.В., Семенников, Асанов И.В., Морозова Н.Б., Игуменов И.К., Журн. хим. Термодинамика 69 (2014) 137–144. | ||||||||||||||
| Цезий-иттрий тетракис (2,2,6,6-тетраметил-3,5-гептандионат) | возгоняется при 230 °C | А.А. Воробьёв, Курсовая работа, http://www.bibliofond.ru/view.aspx?id=555884. | |||||||||||||
| Цезий-иттрий тетракис (гексафторацетилацетонат) CS[Y(CF3COCHCOCF3)4] | М.Дж. Беннетт, Ф.А. Коттон, П. Легздиньш, С.Дж. Липпард, Inorg. Chem., 1968, 7 (9), стр. 1770–1776, | ||||||||||||||
| Цезий-лантан тетракис (гексафторацетилацетонат) | C, E. Higgins, J. Inorg. Nucl. Chem., 1973, Vol 35, Iss. 6p. 1941–1944 | ||||||||||||||
| Цезий-европий тетракис (гексафторацетилацетонат) | [i] C, E. Higgins, J. Inorg. Nucl. Chem., 1973, т. 35, вып. 6 стр. 1941–1944 [ii] JH Burns, MD Danford, Inorg. Chem., 1969, 8 (8), стр. 1780–1784, doi :10.1021/ic50078a048, | ||||||||||||||
| Ацетилацетонат рубидия RbC5H7O2 | 66169-93-5 | температура плавления: 200 °C | Ч.Р. Бхаттачарджи, М. Бхаттачарджи; М.К. Чаудхури, Х. Сангчунгнунга, J. Chem. Рез. Синопсисы, 1991, №9, стр. 250–251. | ||||||||||||
| Рубидий 2,2,6,6-тетраметилгептан-3,5-дионат C11H19O2Rb | 166439-15-2 | Было обнаружено, что Rb(thd) полностью нерастворим в сверхкритическом CO2 (0 моль/л) при следующих условиях: 100-200 бар/ 60 °C | О. Ашенбреннер, С. Кемпер, Н. Дамен, К. Шабер, Э. Диньюс, Дж. Сверхкритические жидкости, 2007, Том 41, Выпуск 2, с. 179–186 | ||||||||||||
| Триметилсилилоксид рубидия | сублимируется при 80 °C/10-6 Торр и разлагается при 140 °C | ||||||||||||||
| Изопропоксид рубидия Rb(OiPr) | сублимируется в глубоком вакууме (10-6 Торр), несмотря на свою полимерную природу, как ни странно, сублимируется при более высокой температуре (200 °C) | ||||||||||||||
| трет-бутоксид рубидия Rb(OtBu) | сублимируется при 185-200 °C/10-2 Торр. | М. Х. Чисхолм, С. Р. Дрейк, А. А. Наини, В. Е. Стрейб, Многогранник, 1991, Vol. 10, Вып.3, с. 337–345 | |||||||||||||
| Диметилалюминийацетилацетонат (CH3)2Al(C5H7O2) | Г. А. Баттистон, Дж. Карта, Г. Кавинато, Р. Гербаси, М. Порчиа Г. Россетто, Chem.Vapor.Dep., 2001, Том 7, Выпуск 2, страницы 69–74. | ||||||||||||||
| Диэтилалюминийацетилацетонат | Г. А. Баттистон, Дж. Карта, Г. Кавинато, Р. Гербаси, М. Порчиа Г. Россетто, Chem.Vapor.Dep., 2001, Том 7, Выпуск 2, страницы 69–74. | ||||||||||||||
| Ацетилацетонат диизобутилалюминия | Г. А. Баттистон, Дж. Карта, Г. Кавинато, Р. Гербаси, М. Порчиа Г. Россетто, Chem.Vapor.Dep., 2001, Том 7, Выпуск 2, страницы 69–74. | ||||||||||||||
| Диметиламин алан NH(CH3)2 · AlH3 | |||||||||||||||
| Триметиламин алан AlH3 · N(CH3)3 | 16842-00-5 | /www.sigmaaldrich.com/catalog/product/aldrich/455792 | |||||||||||||
| Триэтиламин алан | Триэтиламин алан (TEAA) разлагается на поверхности монокристалла Al(111) при температурах выше -310 К | Дюбуа, Л. Х., Зегарски, Б. Р., Гросс, М. Э. и Нуццо, Р. Г. 1991, Наука о поверхностях, 244(1-2), 89–95. | |||||||||||||
| Диметилэтиламин алан C2H5N(CH3)2 · AlH3 | 124330-23-0 | www.sigmaaldrich.com/catalog/product/aldrich/400386?lang=it®ion=IT | |||||||||||||
| Диметилалюминийгидрид (CH3)2AlH | 865-37-2 | www.americanelements.com/dimethylaluminum-hydride-865-37-2#:~:text=Dimethylaluminum%20Hydride%20is%20one%20of,portable%20sources%20of%20водород%20газ. | |||||||||||||
| Ди-изобутилалюминийгидрид [(CH3)2CHCH2]2AlH | 1191-15-7 | /www.sigmaaldrich.com/catalog/product/aldrich/190306 | |||||||||||||
| Кальций бис(циклопентадиенил) (калькоцен) C10H10Ca | Идентификатор PubChem: 100977887 | pubchem.ncbi.nlm.nih.gov/compound/Bis_2_4-циклопентадиенил_-кальций | |||||||||||||
| Кальций бис(изопропилциклопентадиенил) [(C3H7)3C5H2]2Ca · (CH3OCH2)2 | ereztech.com/product/bistri-изопропилциклопентадиенилкальций-12-диметоксиэтан-аддукт-на/ | ||||||||||||||
| кальций бис[бис(триметилсилил)амид C12H36CaN2Si4 | Идентификатор ChemSpider: 9243563 | /www.chemspider.com/Chemical-Structure.9243563.html | |||||||||||||
| кальций бис[бис(триметилсилил)амид диметоксиэтан | Маттиас. Вестерхаузен, Неорганическая химия 1991 30 (1), 96-101 | ||||||||||||||
| кальций бис[бис(триметилсилил)амид тетрагидрофуран | Маттиас. Вестерхаузен, Неорганическая химия 1991 30 (1), 96-101 | ||||||||||||||
| Бис(ацетилацетонат) кальция Ca(CH3COCHCOCH3)2 | 19372-44-2 | Температура плавления >280 °C | www.americanelements.com/calcium-acetylacetonate-19372-44-2 | ||||||||||||
| Кальций бис(гексафторацетилацетонат) тетраглим | [i] Маландрино Г., Кастелли Ф. и Фрагала Иллинойс, Inorganica Chimica Acta, 1994, 224(1-2), 203–207. [ii] Д.М. Цымбаренко и др. / Многогранник 134 (2017) 246–256 | ||||||||||||||
| Кальций бис(2,2,6,6-тетраметил-3,5-гептандонат) Ca(OCC(CH3)3CHCOC(CH3)3)2 | 118448-18-3 | 221-224 °С | www.sigmaaldrich.com/catalog/product/aldrich/362956?lang=it®ion=IT | ||||||||||||
| Кальций 1,1,1,2,2,3,3,7,7,8,8,9,9,9-тетрадекафторнонан-4,6-дионат моногидрат | Саймон К. Томпсон, Дэвид Дж. Коул-Гамильтон, Дуглас Д. Джиллиланд, Майкл Л. Хитчман, Джон К. Барнс, Advanced Materials for Optics and Electronics, том 1, выпуск 2, страницы 81–97, апрель 1992 г. | ||||||||||||||
| Бис(трет-бутил)диметилкетиминат кальция | Эль-Кадери, Х.М., Хиг, М.Дж. и Винтер, Ч.Х., Металлоорганические соединения, 23(21), 2004, 4995–5002. | ||||||||||||||
| Бис(изопропил)диметилкетиминат кальция | Эль-Кадери, Х.М., Хиг, М.Дж. и Винтер, Ч.Х., Металлоорганические соединения, 23(21), 2004, 4995–5002. | ||||||||||||||
| Хром (III) 2-этилгексаноат C24H45CrO6 | 3444-17-5 | www.chemicalbook.com/ChemicalProductProperty_EN_CB5738861.htm | |||||||||||||
| Диэтилдитиокарбамат хрома (III) | Седлачек Дж., Мартинс ЛМДРС, Данек П., Помбейро ЭйЛ и Цвек Б., Журнал прикладной биомедицины, 2014, 12 (4), | ||||||||||||||
| Трис(ацетилацетонат) хрома Cr(C5H7O2)3 | 21679-31-2 | www.sigmaaldrich.com/catalog/product/aldrich/574082?lang=it®ion=IT | |||||||||||||
| Трис(трифторацетилацетонат) хрома Cr(C5H4F3O2)3 | 14592-89-3 | /www.sigmaaldrich.com/catalog/product/aldrich/495697?lang=it®ion=IT | |||||||||||||
| Трис(гексафторацетилацетонат) хрома Cr(CF3COCHCOCF3)3 | 14592-80-4 | www.americanelements.com/chromium-iii-гексафторацетилацетонат-14592-80-4 | |||||||||||||
| хром трис(2,2,6,6-тетраметил-3,5-гептандионат) Cr(OCC(CH3)3CHCOC(CH3)3)3 | 14434-47-0 | www.sigmaaldrich.com/catalog/product/aldrich/468223?lang=it®ion=IT | |||||||||||||
| Диспрозий трис(ацетилацетонат) Dy(C5H7O2)3• xH2O | 18716-76-2 | www.americanelements.com/dysprosium-acetylacetonate-18716-76-2#:~:text=Dysprosium%20Acetylacetonate%20is%20one%20of,energy%20and%20water%20treatment%20applications. | |||||||||||||
| Диспрозий трис(2,2,6,6-тетраметил-3,5-гептандионат) Dy(C11H19O2)3 | 15522-69-7 | www.americanelements.com/tris-2-2-6-6-tetramethyl-3-5-heptanedionato-dysprosium-iii-15522-69-7 | |||||||||||||
| Диспрозий трис(6-этил-2,2-диметил-3,5-декандионат) Dy(OCC(CH3)3CHCOCF2CF2CF3)3 | 18323-98-3 | www.sigmaaldrich.com/catalog/product/aldrich/237280?lang=it®ion=IT | |||||||||||||
| Диспрозий трис(изопропоксид) Dy(OC3H7)3 | 6742-68-3 | www.americanelements.com/dysprosium-iii-isopropoxy-6742-68-3 | |||||||||||||
| Диспрозий трис(1-метокси-2-метил-2-пропанолат) | Ван Эльшохт, С., Ленен, П., Зейтцингер, Б., Абрутис, А., Адельманн, К., Брийс, Б., ... Хейнс, М., Журнал Электрохимического общества, 153 (9), 2006 г. |
Ссылки
- ^ abcdefghijklmnopqrstu vwxy Джонс, Энтони С.; Хитчман, Майкл Л., ред. (22 декабря 2008 г.). Химическое осаждение из паровой фазы. RSC Publishing. doi : 10.1039/9781847558794. ISBN 9780854044658.
- ^ abcdefghijklm Stringfellow, GB (июль 1988). "Негидридные источники группы V для OMVPE". Journal of Electronic Materials . 17 (4): 327– 335. Bibcode : 1988JEMat..17..327S. doi : 10.1007/BF02652114.
- ^ abcdefghij Carmalt, CJ; Basharat, S. (2007). «Обзор химического осаждения из паровой фазы». Комплексная металлоорганическая химия III | ScienceDirect . Т. 12. Elsevier. С. 1– 34.
- ^ abcdefg Мори, Фрэнсис (ноябрь 1991 г.). «Металлоорганические молекулярные прекурсоры для низкотемпературной MOCVD полупроводников III-V». Продвинутые материалы . 3 (11): 542–548 . Бибкод : 1991АдМ.....3..542М. дои : 10.1002/adma.19910031104.
- ^ аб Фишер, Роланд А. (2 июня 1995 г.). «Химия металлов CVD. Herausgegeben vonT. T. Kodas und M. J. Hampden-Smith. VCH Verlagsgesellschaft, Weinheim, 1994. 538 S., Geb. 228.00 DM. – ISBN 3-527-29071-0». Ангеванде Хеми . 107 (11): 1366–1367 . Бибкод : 1995AngCh.107.1366F. дои : 10.1002/ange.19951071132.
- ^ ab Vahlas, Constantin (февраль 2010 г.). "Химическое осаждение металлов из паровой фазы: от унарных систем до сложных металлических сплавов". В Esther Belin-Ferré (ред.). Поверхностные свойства и проектирование сложных интерметаллических соединений . Серия книг по сложным металлическим сплавам. Том 3. стр. 49–81 . Bibcode :2010spec.book.....B. doi :10.1142/7733. ISBN 9789814304771.
- ^ Аб Деви, Анджана (декабрь 2013 г.). "«Старые химические соединения» для новых приложений: перспективы разработки прекурсоров для приложений MOCVD и ALD». Обзоры координационной химии . 257 ( 23– 24): 3332– 3384. doi :10.1016/j.ccr.2013.07.025.
- ^ Кондорелли, Гульельмо Г.; Маландрино, Грациелла; Фрагала, Игнацио Л. (июль 2007 г.). «Разработка молекулярной архитектуры предшественников β-дикетоната для создания новых современных материалов». Обзоры координационной химии . 251 ( 13–14 ): 1931–1950 . doi :10.1016/j.ccr.2007.04.016.
- ^ Malandrino, Graziella; Fragalà, Ignazio L. (июнь 2006 г.). «Прекурсоры лантаноидов «второго поколения» для применений MOCVD: влияние ионного радиуса металла и длины полиэфира на координационные сферы и свойства массопереноса». Coordination Chemistry Reviews . 250 ( 11– 12): 1605– 1620. doi :10.1016/j.ccr.2006.03.017.