Связь Либескинда–Срогля
| Связь Либескинда–Срогля | |
|---|---|
| Назван в честь | Ланни С. Либескинд, Иржи Срогль |
| Тип реакции | Реакция сочетания |
| Идентификаторы | |
| Идентификатор онтологии RSC | Номер заказа:0000604 |
Реакция сочетания Либескинда–Срогля — это органическая реакция , в ходе которой образуется новая углерод-углеродная связь из тиоэфира и бороновой кислоты с использованием металлического катализатора . Это реакция кросс-сочетания . [1] Эта реакция была изобретена и названа в честь Иржи Срогля из Академии наук, Чешская Республика, и Лэнни С. Либескинда из Университета Эмори, Атланта, Джорджия, США. Существует три поколения этой реакции, первое поколение показано ниже. В исходном преобразовании использовался каталитический Pd(0), TFP = трис(2-фурил)фосфин в качестве дополнительного лиганда и стехиометрический CuTC = тиофен-2-карбоксилат меди(I) в качестве сометаллического катализатора. Общая схема реакции показана ниже.
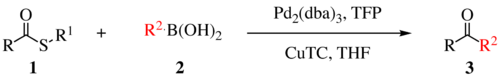
Реакция Либескинда-Срогля чаще всего наблюдается с сульфидными или тиоэфирными электрофилами и нуклеофилами бороновой кислоты или станнана, но жизнеспособны и многие другие партнеры по связыванию . В дополнение к алкил- и арилтиоэфирам; (гетеро)арилсульфиды, тиоамиды, сульфанилалкины и тиоцианаты являются компетентными электрофилами. [2] Была продемонстрирована практически любая связь металл-R, способная к трансметаллированию . [2] Нуклеофилы, полученные из индия, не требуют меди или основания. Обратите внимание, что эта область применима для связывания первого поколения, поскольку второе и третье поколения механистически различны и были продемонстрированы только с тиоэфирами, способными образовывать шестичленный металлоцикл , бороновыми кислотами и станнанами .

Подход первого поколения к перекрестному связыванию осуществляется в анаэробных условиях с использованием стехиометрической меди и каталитического палладия. [1]
Подход второго поколения делает реакции каталитическими в меди, используя дополнительный эквивалент бороновой кислоты в аэробных условиях, свободных от палладия. [3] Дополнительный эквивалент освобождает медь от вспомогательной серы и позволяет ей переходить. Эта химия ограничена тиоэфирами и сульфидами и также может быть ограничена стоимостью и доступностью борорганического реагента .
Третье поколение делает реакцию каталитической в меди, используя только один эквивалент бороновой кислоты. [4]
Механизм
Поколение 1
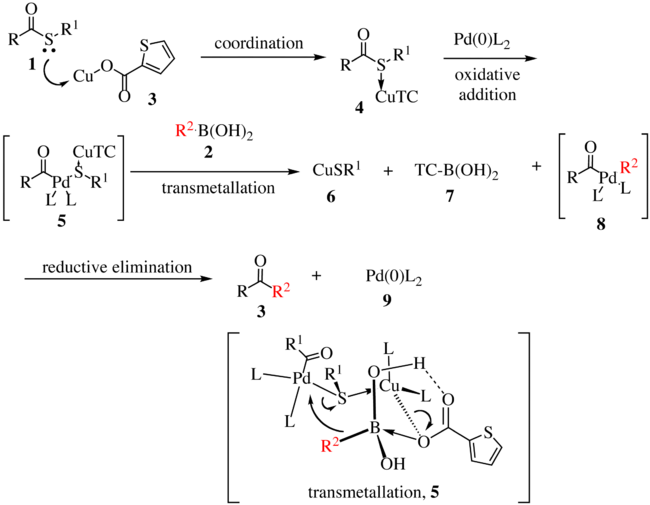
Предложенный механизм реакции для первого поколения показан ниже. [5] [6] Тиоэфир 1 образует комплексы с медным комплексом 3, образуя соединение 4. При окислительном внедрении [Pd] в связь углерод-сера образуется соединение 5 , а при трансметаллировании образуется органопалладиевый вид 8. Трансметаллирование протекает через перенос R 2 на металлический центр палладия с сопутствующим переносом атома серы на медный комплекс. Восстановительное элиминирование дает кетон 3 с регенерацией активного катализатора 9 .
Поколение 2
Механизм для второго поколения показан ниже. [3] Механизм не следует традиционному пути окислительного присоединения-трансметеляции-восстановительного элиминирования, как в первом поколении. Параллельно с исследованиями реакций Cu(I)-дикислород, предлагается более высокая степень окисления, Cu-шаблонное связывание. [7] [8] [9] [10] [11] Координация меди(I) с тиоэфиром подвергается окислению воздухом с образованием промежуточного соединения меди (II/III). Металлическое шаблонирование Cu(II/III) действует как кислота Льюиса, чтобы активировать тиоловый эфир и доставлять R2 ( либо из бора напрямую, либо через промежуточные виды Cu-R2 ) , что дает кетон и Cu-тиолят. Второй эквивалент бороновой кислоты необходим для разрыва связи меди с серой и высвобождения меди обратно в каталитический цикл.

Поколение 3
Третье поколение делает реакцию каталитической в меди и использует только один эквивалент бороновой кислоты, имитируя систему металлотионеина (MT), которая вымывает металлы из биологических систем. [4] Тио-вспомогательное вещество имеет мотив N–O, который имитирует мотив S–S в биосистеме MT, который необходим для разрыва связи меди серы и превращения катализатора. Это поколение не содержит палладия и находится в микроволновых условиях. Ожидается, что механизм будет следовать механизму второго поколения (показано как активный вид Cu(I)-R 2 , но R 2 может быть доставлен непосредственно из координированной бороновой кислоты), но включает вспомогательное вещество, высвобождающее медь обратно в каталитический цикл вместо дополнительной бороновой кислоты.

Применение в синтезе
Сочетание Либескинда–Срогля использовалось в качестве ключевого ретросинтетического разрыва в нескольких процессах полного синтеза природных продуктов .
Например, при синтезе гониодомина А лаборатория Сасакки использовала эту химию для быстрого доступа к северной половине натурального продукта. [12]

В лаборатории Герреро использовали реакцию связи Либескинда-Срогля для построения полного углеродного скелета виридина с высоким выходом в многограммовом масштабе. [13]

Лаборатория Фигадере использовала реакцию сочетания Либескинда–Срогля на ранних этапах синтеза амфидинолида F [14], используя эту реакцию для построения северо-восточного фрагмента макроцикла и терпеновой цепи.

Другой
Направленная дифункционализация
Лаборатория Ю продемонстрировала, что в присутствии двух сульфидных связей одна из них может быть селективно функционализирована в присутствии одного эквивалента нуклеофила, если она направлена карбонильным кислородом. [15] Эта реакция протекает через пятичленный палладацикл с окислительным присоединением, происходящим на этом цис -тиоэфире. Дополнительная эквивалентность нуклеофила функционализирует транс- позицию.

Ссылки
- ^ ab Liebeskind, L.; Srogl, Jiri (2000). «Связывание эфира тиола с борной кислотой. Беспрецедентный механический и общий синтез кетонов». J. Am. Chem. Soc. 122 (45): 11260– 11261. doi :10.1021/ja005613q.
- ^ ab Cheng, Hong-Gang; Chen, Han; Liu, Yue; Zhou, Qianghui (март 2018 г.). «Реакция кросс-сочетания Либескинда-Срогля и ее синтетические применения». Asian Journal of Organic Chemistry . 7 (3): 490– 508. doi : 10.1002/ajoc.201700651 .
- ^ ab Villalobos, Janette M.; Srogl, Jiri; Liebeskind, Lanny S. (декабрь 2007 г.). "Новая парадигма образования углерод-углеродной связи: аэробное, медно-шаблонное кросс-сочетание". Журнал Американского химического общества . 129 (51): 15734– 15735. doi :10.1021/ja074931n. ISSN 0002-7863. PMC 2561227. PMID 18047333 .
- ^ ab Zhang, Zhihui; Lindale, Matthew G.; Liebeskind, Lanny S. (27 апреля 2011 г.). «Мобилизация Cu(I) для катализа образования углерод-углеродной связи в присутствии тиолята. Химическая имитация металлотионеинов». Журнал Американского химического общества . 133 (16): 6403– 6410. doi :10.1021/ja200792m. ISSN 0002-7863. PMC 3128984. PMID 21449537 .
- ^ Ю, Й.; Либескинд, Л.С. (2004). «Меди-опосредованное, катализируемое палладием сочетание тиоловых эфиров с алифатическими борорганическими реагентами». J. Org. Chem. 69 (10): 3554– 3557. doi :10.1021/jo049964p. PMID 15132570.
- ^ ^ Villalobos, JM; Srogl, J.; Liebeskind, LS (2007). «Новая парадигма образования связи углерод-углерод: аэробное, медно-шаблонное кросс-сочетание». J. Am. Chem. Soc. 129 (51): 15734– 15735. doi :10.1021/ja074931n. PMC 2561227 . PMID 18047333.
- ^ Хэтчер, Лэнинг К.; Вэнс, Майкл А.; Нардуччи Сарджент, Эми А.; Соломон, Эдвард И.; Карлин, Кеннет Д. (апрель 2006 г.). «Аддукты меди и дикислорода и равновесие пероксодимедь(II)/бис(μ-оксо)димедь(III): значительные электронные эффекты лиганда». Неорганическая химия . 45 (7): 3004– 3013. doi :10.1021/ic052185m. ISSN 0020-1669. PMID 16562956.
- ^ Mirica, Liviu M.; Rudd, Deanne Jackson; Vance, Michael A.; Solomon, Edward I.; Hodgson, Keith O.; Hedman, Britt; Stack, T. Daniel P. (март 2006 г.). «μ-η2:η2-Peroxodicopper(II) Complex with a Secondary Diamine Ligand: A Functional Model of Tyrosinase». Журнал Американского химического общества . 128 (8): 2654– 2665. doi :10.1021/ja056740v. ISSN 0002-7863. PMID 16492052.
- ^ Мацумото, Такахиро; Фурутачи, Хидеки; Кобино, Масаси; Томии, Масато; Нагатомо, Сигенори; Тоша, Такэхико; Осако, Такао; Фудзинами, Шухэй; Ито, Синобу (март 2006 г.). «Внутримолекулярное гидроксилирование аренов по сравнению с межмолекулярным эпоксидированием олефинов комплексом (μ-η2:η2-пероксо)димеди (II), поддерживаемым двуядерным лигандом». Журнал Американского химического общества . 128 (12): 3874–3875 . doi :10.1021/ja058117g. ISSN 0002-7863. ПМИД 16551071.
- ^ Льюис, Элизабет А.; Толман, Уильям Б. (февраль 2004 г.). «Реакционная способность систем диоксида кремния–медь». Chemical Reviews . 104 (2): 1047– 1076. doi :10.1021/cr020633r. ISSN 0009-2665. PMID 14871149.
- ^ Chemical Reviews . 104 (8): 6. 11 августа 2004 г. doi :10.1021/cr040141+. ISSN 0009-2665.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - ^ Сайто, Томоюки; Фува, Харухико; Сасаки, Макото (19 ноября 2009 г.). «На пути к полному синтезу гониодомина А, морского полиэфирного макролида, нацеленного на актин: конвергентный синтез сегмента C15-C36». Органические письма . 11 (22): 5274–5277 . doi :10.1021/ol902217q. ISSN 1523-7060. ПМИД 19905029.
- ^ Del Bel, Matthew; Abela, Alexander R.; Ng, Jeffrey D.; Guerrero, Carlos A. (24 мая 2017 г.). «Энантиоселективные химические синтезы фураностероидов (−)-виридина и (−)-виридиола». Журнал Американского химического общества . 139 (20): 6819– 6822. doi :10.1021/jacs.7b02829. ISSN 0002-7863. PMID 28463562.
- ^ Феррие, Лоран; Феннето, Йохан; Фигадер, Бруно (июнь 2018 г.). «Полный синтез морского макролида амфидинолида F» (PDF) . Organic Letters . 20 (11): 3192– 3196. doi :10.1021/acs.orglett.8b01020. ISSN 1523-7060. PMID 29762038.
- ^ Jin, Weiwei; Du, Wangming; Yang, Qin; Yu, Haifeng; Chen, Jiping; Yu, Zhengkun (19 августа 2011 г.). «Регио- и стереоселективный синтез многозамещенных олефинов и сопряженных диенов с использованием α-оксокетендитиоацеталей в качестве строительных блоков». Organic Letters . 13 (16): 4272– 4275. doi :10.1021/ol201620g. ISSN 1523-7060. PMID 21761823.
