Реактив Лоуссона
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,4-Бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид | |
| Предпочтительное название ИЮПАК 2,4-Бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дитион | |
| Другие имена Реагент Лавессона; LR | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.038.944 |
| Номер ЕС |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С14Н14О2П2С4 | |
| Молярная масса | 404,45 г·моль −1 |
| Появление | Слегка желтый порошок |
| Температура плавления | 228–231 °C (442–448 °F; 501–504 К) |
| Нерастворимый | |
| Опасности | |
| Маркировка СГС : | |
  | |
| Предупреждение | |
| Н261 , Н302 , Н312 , Н332 | |
| Р231+Р232 , Р261 , Р264 , Р270 , Р271 , Р280 , Р301+Р312 , Р302+Р352 , Р304+Р312 , Р304+Р340 , Р312 , Р322 , Р330 , Р363 , Р370 +Р378 , Р402+Р404 , Р501 | |
| Родственные соединения | |
Связанные тиатионные агенты | Сероводород , Пентасульфид фосфора |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Реагент Лоуссона ( LR ) — это химическое соединение, используемое в органическом синтезе в качестве тиирующего агента. Реагент Лоуссона впервые стал популярен благодаря Свену-Олову Лоуссону , который, однако, не изобрел его. Реагент Лоуссона был впервые получен в 1956 году в ходе систематического изучения реакций аренов с P 4 S 10 . [1]
Подготовка
Реактив Лоуссона имеется в продаже. Его также можно легко приготовить в лаборатории, нагревая смесь анизола с пентасульфидом фосфора до тех пор, пока смесь не станет прозрачной и не прекратится образование сероводорода , [2] затем перекристаллизовать из толуола или ксилола .
Образцы дают сильный запах сероводорода из-за частичного гидролиза. Одним из распространенных и эффективных методов уничтожения неприятно пахнущих остатков является использование избытка гипохлорита натрия ( хлорного отбеливателя ).
Механизм действия
Реагент Лоуссона имеет четырехчленное кольцо из чередующихся атомов серы и фосфора . Центральное фосфорно-серное четырехчленное кольцо диссоциирует с образованием двух реакционноспособных дитиофосфинилидов ( R-PS 2 ). Большая часть химии реагента Лоуссона на самом деле является химией этого реакционноспособного промежуточного соединения.
В общем случае, чем больше электронов в карбониле, тем быстрее карбонильная группа будет преобразована в соответствующий тиокарбонил реагентом Лоуссона.
Приложения
Химия реагента Лоуссона и родственных веществ была рассмотрена несколько раз. [3] [4] [5] [6] Основное применение реагента Лоуссона — тионирование карбонильных соединений. Например, реагент Лоуссона преобразует карбонил в тиокарбонил . [7] Кроме того, реагент Лоуссона использовался для тионирования енонов , эфиров , [8] лактонов , [9] амидов , лактамов , [10] и хинонов .
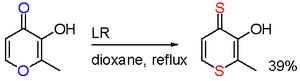
В одном исследовании реакция мальтола с LR приводит к селективной замене кислорода в двух позициях. [11]
Комбинация перхлората серебра и реагента Лоуссона способна действовать как оксофильная кислота Льюиса , способная катализировать реакцию Дильса-Альдера диенов с α,β-ненасыщенными альдегидами .
В некоторых случаях спирты могут быть преобразованы в тиолы путем обработки реагентом Лоуссона. [12]
Реагент Лауссона реагирует с сульфоксидами с образованием тиоэфиров. [5]
Смотрите также
Ссылки
- ^ Lecher, HZ; Greenwood, RA; Whitehouse, KC; Chao, TH (1956). «Фосфонирование ароматических соединений пентасульфидом фосфора». J. Am. Chem. Soc. 78 (19): 5018. doi :10.1021/ja01600a058.
- ^ Томсен, И.; Клаузен, К.; Шайби, С.; Лавессон, С.-О. (1984). "Тиирование с 2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетаном 2,4-дисульфидом: N -метилтиопирролидон". Органические синтезы . 62 : 158. doi :10.15227/orgsyn.062.0158.
- ^ Черкасов, РА; Кутырев, ГА; Пудовик, АН (1985). "Tetrahedron report number 186. Тиофосфорорганические реагенты в органическом синтезе". Tetrahedron (Обзор). 41 (13): 2567. doi :10.1016/S0040-4020(01)96363-X.
- ^ Форман, М.С.; Вуллинз, Дж.Д. (2000). «Гетероциклы органо-P–S и P–Se». J. Chem. Soc., Dalton Trans. (10): 1533–1543. doi :10.1039/b000620n.
- ^ ab Мартин Йесбергер; Томас П. Дэвис; Леони Барнер (2003). «Применение реагента Лоуссона в органических и металлоорганических синтезах». Синтез (обзор). 2003 (13): 1929–1958. doi :10.1055/s-2003-41447.
- ^ Кава, MP; Левинсон, MI (1985). «Реакции тионирования реагентов Лоуссона». Tetrahedron . 41 (22): 5061–5087. doi :10.1016/S0040-4020(01)96753-5.
- ^ Педерсен, Б.С.; Шайби, С.; Нильссон, Н.Х.; Лавессон, С.-О. (1978). «Исследования фосфорорганических соединений XX. синтезы тиокетонов». Bull. Soc. Chim. Belg. 87 (3): 223–228. doi :10.1002/bscb.19780870310.
- ^ Джонс, BA; Брэдшоу, JS (1984). "Синтез и восстановление тиокарбоновых O -эфиров". Chem. Rev. (Обзор). 84 (84): 17. doi :10.1021/cr00059a002.
- ^ Шайби, С.; Кристенсен Дж.; Ловессон, С.-О. (1979). «Исследования фосфорорганических соединений XXVII. Синтез тионо-, тиоло- и дитиолактонов». Тетраэдр . 35 (11): 1339–1343. дои : 10.1016/0040-4020(79)85027-9.
- ^ Шабана, Р.; Шайби, С.; Клаузен, К.; Олесен, СО; Лавессон, С.-О. (1980). «Исследования фосфорорганических соединений XXXI. Синтез тиолактамов и тиоимидов». Nouveau Journal de Chimie . 1980 (4): 47.
- ^ Brayton, D.; Jacobsen, FE; Cohen, SM; Farmer, PJ (2006). «Новая реакция обмена гетероциклическими атомами с реагентом Лоуссона: однореакторный синтез дитиомальтола». Chemical Communications . 2006 (2): 206–208. doi :10.1039/b511966a. PMID 16372107.
- ^ Нисио, Такехико (1989). «Новое превращение спиртов в тиолы». Журнал химического общества, Chemical Communications . 1989 (4): 205–206. doi :10.1039/C39890000205.
Внешние ссылки
- "Реагент Лоуссона". Портал органической химии . Получено 16 октября 2007 г.