ДНК-лигаза 1
| ЛИГ1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | LIG1 , ДНК-лигаза 1, LIGI, hLig1, IMD96 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 126391; МГИ : 101789; Гомологен : 197; Генные карты : LIG1; OMA :LIG1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
ДНК-лигаза 1, также ДНК-лигаза I , — фермент , который у людей кодируется геном LIG1 . ДНК-лигаза 1 — единственная известная эукариотическая ДНК-лигаза, участвующая как в репликации , так и в репарации ДНК , что делает ее наиболее изученной из лигаз .
Открытие
Было известно, что репликация ДНК происходит посредством разрыва двойной цепи , но фермент, ответственный за обратное сшивание цепей, и механизм его действия были неизвестны до тех пор, пока лаборатории Лемана, Геллерта, Ричардсона и Гурвица не внесли значительный вклад в открытие ДНК-лигазы в 1967 году. [5]

Набор и регулирование
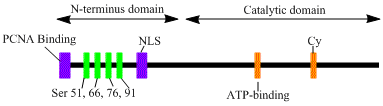
LIG1 кодирует фермент 120 кДа, длиной 919 остатков , известный как ДНК-лигаза 1. Полипептид ДНК-лигазы 1 содержит последовательность нацеливания на репликационную фабрику N-конца (RFTS), за которой следует последовательность ядерной локализации (NLS) и три функциональных домена. [6] Три домена состоят из домена связывания ДНК N-конца (DBD), каталитической нуклеотидилтрансферазы (NTase) и доменов связывания олигонуклеотида / олигосахарида C-конца (OB). Хотя N-конец пептида не обладает каталитической активностью, он необходим для активности внутри клеток. N-конец белка содержит последовательность нацеливания на репликационную фабрику, которая используется для его привлечения на сайты репликации ДНК, известные как репликационные фабрики.
Активация и привлечение ДНК-лигазы 1, по-видимому, связаны с посттрансляционными модификациями. N-концевой домен завершается фосфорилированием четырех остатков серина на этом домене, Ser51, Ser76 и Ser91 циклин-зависимой киназой (CDK) и Ser66 казеинкиназой II (CKII). Было показано, что фосфорилирование этих остатков (в частности Ser66) возможно регулирует взаимодействие между RFTS и ядерным антигеном пролиферирующих клеток (PCNA), когда лигаза 1 привлекается к репликационным фабрикам во время S-фазы . [6] [7] Росси и др. предположили, что при дефосфорилировании Ser66 RFTS лигазы 1 взаимодействует с PCNA, что было подтверждено in vitro Томом и др. Оба набора данных предоставляют правдоподобные доказательства того, что N-концевой регион лигазы I играет регуляторную роль в функционировании ферментов in vivo в ядре. [7] [8] Более того, мутационный анализ показал, что идентификация мотива связывания циклина (Cy) в каталитическом домене C-конца играет роль в фосфорилировании серинов 91 и 76. Вместе N-концевые серины являются субстратами CDK и CKII, которые, по-видимому, играют важную регуляторную роль в привлечении ДНК-лигазы I на фабрику репликации во время S-фазы клеточного цикла . [ 6] [9]
Функция и механизм
LIG1 кодирует ДНК-лигазу 1, которая участвует в репликации ДНК и процессе репарации оснований . [10]
Эукариотическая ДНК-лигаза 1 катализирует реакцию, которая химически универсальна для всех лигаз. ДНК-лигаза 1 использует аденозинтрифосфат (АТФ) для катализа энергетически выгодных событий лигирования как при репликации , так и при репарации ДНК . Во время фазы синтеза (S-фазы) эукариотического клеточного цикла происходит репликация ДНК. ДНК-лигаза 1 отвечает за соединение фрагментов Оказаки, образованных во время прерывистого синтеза ДНК на отстающей цепи ДНК после того, как ДНК-полимераза δ заменила нуклеотиды праймера РНК на нуклеотиды ДНК. Если фрагменты Оказаки не лигированы должным образом, нелигированная ДНК (содержащая «разрыв») может легко деградировать до двухцепочечного разрыва , явления, которое, как известно, вызывает генетические мутации. Чтобы лигировать эти фрагменты вместе, лигаза проходит три этапа:
- Добавление группы аденозинмонофосфата (АМФ) к ферменту, называемое аденилированием,
- Перенос аденозинмонофосфата в ДНК и
- Запечатывание нитей или образование фосфодиэфирной связи. [8] [11]

Во время аденилирования происходит нуклеофильная атака на альфа-фосфат АТФ со стороны каталитического лизина , что приводит к образованию неорганического пирофосфата (PPi) и ковалентно связанного промежуточного соединения лизин-АМФ в активном центре ДНК-лигазы 1.
На этапе переноса AMP ДНК-лигаза связывается с ДНК, находит разрыв и катализирует реакцию на 5'-фосфатном участке разрыва ДНК. Анионный кислород на 5'-фосфате разрыва ДНК выступает в качестве нуклеофила, атакуя альфа-фосфат ковалентно связанного AMP, в результате чего AMP становится ковалентно связанным промежуточным соединением (промежуточным соединением ДНК-AMP).
Для образования фосфодиэфирной связи необходимо отщепить промежуточное соединение ДНК-АМФ. Для выполнения этой задачи происходит нуклеофильная атака на 5'-фосфат с вышестоящего 3'-гидроксила, что приводит к образованию фосфодиэфирной связи. Во время этой нуклеофильной атаки группа АМФ отталкивается от 5'-фосфата как уходящая группа, что позволяет запечатать разрыв и высвободить АМФ, завершая один цикл лигирования ДНК.
При неоптимальных условиях лигаза может отделиться от ДНК до завершения полной реакции. Было показано, что уровни магния могут замедлить процесс запечатывания разрыва, заставляя лигазу отделиться от ДНК, оставляя абортированный аденилилированный промежуточный продукт, неспособный быть зафиксированным без помощи фосфодиэстеразы . Было показано, что апратаксин (фосфодиэстераза) действует на абортированные промежуточные продукты ДНК посредством гидролиза связи AMP-фосфат, восстанавливая ДНК в ее первоначальное состояние до реакции лигазы. [12] [13]
Роль в ремонте поврежденной базы
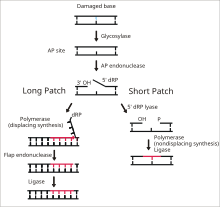
ДНК-лигаза 1 функционирует для лигирования одноцепочечных разрывов ДНК на последнем этапе пути эксцизионной репарации оснований (BER). [14] Азотистые основания ДНК обычно повреждаются под воздействием таких экологических опасностей, как активные формы кислорода , токсины и ионизирующее излучение . BER является основным путем репарации, ответственным за вырезание и замену поврежденных оснований. Лигаза I участвует в пути LP-BER, тогда как лигаза III участвует в основном пути SN-BER (2). [15] LP-BER протекает в 4 каталитических этапа. Сначала ДНК-гликозилаза расщепляет N-гликозидную связь , высвобождая поврежденное основание и создавая сайт AP — сайт, в котором отсутствует пуриновое или пиримидиновое основание. На следующем этапе эндонуклеаза AP создает надрез на 5'-конце сайта AP, образуя свисающий остаток дезоксирибозофосфата (dRP) вместо сайта AP. Затем ДНК-полимераза синтезирует несколько новых оснований в направлении от 5' до 3', создавая свисающий участок ДНК с dRP на 5'-конце. Именно на этом этапе SN-BER и LP-BER расходятся в механизме — в SNBER добавляется только один нуклеотид, а ДНК-полимераза действует как лиаза, вырезая сайт AP. В LP-BER синтезируется несколько оснований, создавая свисающий лоскут ДНК, который расщепляется эндонуклеазой лоскута . Это оставляет после себя надрезанную цепь ДНК, которая обнаруживается и лигируется ДНК-лигазой. [14] [15] [16] Действие лигазы 1 стимулируется другими ферментами LP-BER, в частности AP-эндонуклеазой и ДНК-полимеразой. [16]
Клиническое значение
Мутации в LIG1 , приводящие к дефициту ДНК-лигазы 1, приводят к иммунодефициту и повышенной чувствительности к агентам, повреждающим ДНК. [10]
Имеются редкие сообщения о пациентах, у которых наблюдается дефицит лигазы 1, вызванный унаследованными мутантными аллелями. Первый случай проявился в виде задержки роста и развития и иммунодефицита. Была создана мышиная модель на основе клеточных линий, полученных от пациента, что подтвердило, что мутантная лигаза вызывает ошибки репликации, приводящие к геномной нестабильности . В частности, у мутантных мышей также наблюдалось увеличение опухолеобразования . [8] Были описаны молекулярные, клеточные и клинические особенности 5 пациентов из 3 родословных с биаллельными мутациями. У пациентов наблюдалась гипогаммаглобулинемия, лимфопения, повышенная доля циркулирующих γδT-клеток и очень большие эритроциты (макроцитоз). Клиническая тяжесть варьировалась от легкого дефицита антител до комбинированного иммунодефицита, требующего трансплантации гемопоэтических стволовых клеток. Было показано, что химические и радиационные дефекты нарушают пути репарации ДНК. Таким образом, дефекты ДНК-лигазы 1 могут приводить к различным формам аутосомно-рецессивного частичного дефицита ДНК-лигазы 1, что приводит к иммунодефициту различной степени тяжести. [17]
Также было обнаружено, что лигаза I активируется в пролиферирующих опухолевых клетках, в отличие от доброкачественных опухолевых клеточных линий и нормальных человеческих клеток. Кроме того, было показано, что ингибирование экспрессии лигазы I в этих клетках может иметь цитотоксический эффект, что позволяет предположить, что ингибиторы лигазы I могут быть жизнеспособными химиотерапевтическими агентами. [18]
Дефицит апратаксина , фосфодиэстеразы, ответственной за восстановление ДНК (после того, как ДНК-лигаза I прерывает аденилилированный промежуточный ДНК), был связан с нейродегенерацией . Это говорит о том, что ДНК неспособна повторно войти в путь восстановления без дополнительных резервных механизмов для исправления ошибок лигазы. [13]
Поскольку структура ДНК хорошо известна, а многие компоненты, необходимые для ее обработки, восстановления и использования, идентифицированы и охарактеризованы, исследователи начинают изучать разработку наноскопического оборудования, которое будет включено в живой организм, обладающий способностью лечить болезни, бороться с раком и высвобождать лекарства на основе биологического стимула, предоставляемого организмом наноскопическому оборудованию. ДНК-лигаза, скорее всего, должна быть включена в такую машину. [19]
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000105486 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000056394 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Kresge N, Simoni RD, Hill RL (январь 2007 г.). «Взгляд на соединение ДНК: I. Работа Роберта Лемана по ДНК-лигазе». Журнал биологической химии . 282 (2): e1 – e3 . doi : 10.1016/S0021-9258(20)73504-0 .
- ^ abc Ferrari G, Rossi R, Arosio D, Vindigni A, Biamonti G, Montecucco A (сентябрь 2003 г.). "Зависимое от клеточного цикла фосфорилирование человеческой ДНК-лигазы I на участках циклин-зависимой киназы". Журнал биологической химии . 278 (39): 37761– 7. doi : 10.1074/jbc.M304462200 . PMID 12851383.
- ^ ab Rossi R, Villa A, Negri C, Scovassi I, Ciarrocchi G, Biamonti G, Montecucco A (октябрь 1999 г.). "Последовательность нацеливания репликационной фабрики/сайт связывания PCNA требуется в G(1) для контроля статуса фосфорилирования ДНК-лигазы I". The EMBO Journal . 18 (20): 5745– 54. doi :10.1093/emboj/18.20.5745. PMC 1171641 . PMID 10523317.
- ^ abc Ellenberger T, Tomkinson AE (2008). «Эукариотические ДНК-лигазы: структурные и функциональные идеи». Annual Review of Biochemistry . 77 : 313–38 . doi :10.1146/annurev.biochem.77.061306.123941. PMC 2933818. PMID 18518823 .
- ^ Prigent C, Lasko DD, Kodama K, Woodgett JR, Lindahl T (август 1992 г.). «Активация ДНК-лигазы I млекопитающих посредством фосфорилирования казеинкиназой II». The EMBO Journal . 11 (8): 2925– 33. doi :10.1002/j.1460-2075.1992.tb05362.x. PMC 556774. PMID 1639065 .
- ^ ab "Ген Entrez: лигаза I LIG1, ДНК, АТФ-зависимая".
- ^ Шрисканда В., Шуман С. (январь 1998 г.). «ДНК-лигаза вируса хлореллы: распознавание ников и мутационный анализ». Nucleic Acids Research . 26 (2): 525–31 . doi :10.1093/nar/26.2.525 (неактивен 1 ноября 2024 г.). PMC 147278. PMID 9421510 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка ) - ^ Taylor MR, Conrad JA, Wahl D, O'Brien PJ (июль 2011 г.). «Кинетический механизм человеческой ДНК-лигазы I выявляет магнийзависимые изменения на этапе ограничения скорости, которые снижают эффективность лигирования». Журнал биологической химии . 286 (26): 23054– 62. doi : 10.1074/jbc.M111.248831 . PMC 3123073. PMID 21561855 .
- ^ ab Rass U, Ahel I, West SC (март 2007 г.). «Действия апратаксина в множественных путях репарации ДНК». Журнал биологической химии . 282 (13): 9469–74 . doi : 10.1074/jbc.M611489200 . PMID 17276982.
- ^ ab Sattler U, Frit P, Salles B, Calsou P (апрель 2003 г.). «Синтез репарации ДНК с длинными участками во время репарации эксцизионных оснований в клетках млекопитающих». EMBO Reports . 4 (4): 363– 7. doi :10.1038/sj.embor.embor796. PMC 1319152. PMID 12671676 .
- ^ ab Hegde ML, Hazra TK, Mitra S (январь 2008 г.). «Ранние шаги в пути удаления оснований ДНК/ремонта одноцепочечных прерываний в клетках млекопитающих». Cell Research . 18 (1): 27– 47. doi :10.1038/cr.2008.8. PMC 2692221 . PMID 18166975.
- ^ ab Balakrishnan L, Brandt PD, Lindsey-Boltz LA, Sancar A, Bambara RA (май 2009 г.). «Длинная репарация основания заплаты эксцизионной репарацией осуществляется посредством координированной стимуляции комплекса репарации ДНК мультифермента». Журнал биологической химии . 284 (22): 15158– 72. doi : 10.1074/jbc.M109.000505 . PMC 2685697. PMID 19329425 .
- ^ Maffucci P, Chavez J, Jurkiw TJ, O'Brien PJ, Abbott JK, Reynolds PR и др. (декабрь 2018 г.). «Диаллельные мутации в ДНК-лигазе 1 лежат в основе спектра иммунодефицитов». Журнал клинических исследований . 128 (12): 5489– 5504. doi : 10.1172/JCI99629. PMC 6264644. PMID 30395541 .
- ^ Sun D, Urrabaz R, Nguyen M, Marty J, Stringer S, Cruz E и др. (декабрь 2001 г.). «Повышенная экспрессия ДНК-лигазы I при раке человека». Clinical Cancer Research . 7 (12): 4143– 8. PMID 11751514.
- ^ Macdonald J (ноябрь 2008 г.). «Умная ДНК: программирование молекулы жизни для работы и отдыха [Предварительный просмотр]». scientificamerican . Получено 22.02.2013 .
Дальнейшее чтение
- Leonhardt H, Cardoso MC (1996). "Нацеливание и ассоциация белков с функциональными доменами в ядре: нерастворимое решение". Структурная и функциональная организация ядерного матрикса . Международный обзор цитологии. Т. 162B. С. 303–35 . doi :10.1016/S0074-7696(08)62620-0. ISBN 978-0-12-364566-1. PMID 8557490.
- Tomkinson AE, Mackey ZB (февраль 1998). «Структура и функция ДНК-лигаз млекопитающих». Mutation Research . 407 (1): 1– 9. doi :10.1016/s0921-8777(97)00050-5. PMID 9539976.
- Перриго М., Пьеро-Дезейлиньи Э., Бассель Б., Хелд Дж. П. (апрель 1976 г.). «[Паралич после радикулографии Димера X]». Новая медицинская пресса . 5 (17): 1120–2 . PMID 934827.
- Webster AD, Barnes DE, Arlett CF, Lehmann AR, Lindahl T (июнь 1992 г.). «Задержка роста и иммунодефицит у пациента с мутациями в гене ДНК-лигазы I». Lancet . 339 (8808): 1508– 9. doi :10.1016/0140-6736(92)91266-B. PMID 1351188. S2CID 11874717.
- Barnes DE, Tomkinson AE, Lehmann AR, Webster AD, Lindahl T (май 1992 г.). «Мутации в гене ДНК-лигазы I у человека с иммунодефицитами и клеточной гиперчувствительностью к агентам, повреждающим ДНК». Cell . 69 (3): 495– 503. doi :10.1016/0092-8674(92)90450-Q. PMID 1581963. S2CID 11736507.
- Barnes DE, Kodama K, Tynan K, Trask BJ, Christensen M, De Jong PJ и др. (январь 1992 г.). «Присвоение гена, кодирующего ДНК-лигазу I, человеческой хромосоме 19q13.2-13.3». Genomics . 12 (1): 164– 6. doi :10.1016/0888-7543(92)90422-O. PMID 1733856.
- Petrini JH, Huwiler KG, Weaver DT (сентябрь 1991 г.). «Ген ДНК-лигазы I дикого типа экспрессируется в клетках синдрома Блума». Труды Национальной академии наук Соединенных Штатов Америки . 88 (17): 7615– 9. Bibcode : 1991PNAS...88.7615P. doi : 10.1073/pnas.88.17.7615 . PMC 52352. PMID 1881902 .
- Lasko DD, Tomkinson AE, Lindahl T (июль 1990). «ДНК-лигазы млекопитающих. Биосинтез и внутриклеточная локализация ДНК-лигазы I». Журнал биологической химии . 265 (21): 12618– 22. doi : 10.1016/S0021-9258(19)38388-7 . PMID 2197279.
- Barnes DE, Johnston LH, Kodama K, Tomkinson AE, Lasko DD, Lindahl T (сентябрь 1990 г.). "КДНК человеческой ДНК-лигазы I: клонирование и функциональная экспрессия в Saccharomyces cerevisiae". Труды Национальной академии наук Соединенных Штатов Америки . 87 (17): 6679– 83. Bibcode : 1990PNAS...87.6679B. doi : 10.1073/pnas.87.17.6679 . PMC 54600. PMID 2204063 .
- Montecucco A, Savini E, Weighardt F, Rossi R, Ciarrocchi G, Villa A, Biamonti G (ноябрь 1995 г.). "N-концевой домен человеческой ДНК-лигазы I содержит сигнал ядерной локализации и направляет фермент к сайтам репликации ДНК". The EMBO Journal . 14 (21): 5379– 86. doi :10.1002/j.1460-2075.1995.tb00222.x. PMC 394647 . PMID 7489727.
- Маруяма К, Сугано С (январь 1994). «Олиго-кэппинг: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Gene . 138 ( 1– 2): 171– 4. doi :10.1016/0378-1119(94)90802-8. PMID 8125298.
- Trask B, Fertitta A, Christensen M, Youngblom J, Bergmann A, Copeland A и др. (январь 1993 г.). «Картирование гибридизации флуоресценции in situ человеческой хромосомы 19: расположение цитогенетической полосы 540 космид и 70 генов или ДНК-маркеров». Genomics . 15 (1): 133– 45. doi :10.1006/geno.1993.1021. PMID 8432525.
- Petrini JH, Walsh ME, DiMare C, Chen XN, Korenberg JR, Weaver DT (сентябрь 1995 г.). «Выделение и характеристика человеческого гомолога MRE11». Genomics . 29 (1): 80– 6. doi :10.1006/geno.1995.1217. PMID 8530104.
- Bentley D, Selfridge J, Millar JK, Samuel K, Hole N, Ansell JD, Melton DW (август 1996 г.). «ДНК-лигаза I необходима для фетального печеночного эритропоэза, но не является существенной для жизнеспособности клеток млекопитающих». Nature Genetics . 13 (4): 489– 91. doi :10.1038/ng0896-489. PMID 8696349. S2CID 20264173.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (октябрь 1997 г.). «Конструирование и характеристика библиотеки кДНК с полной длиной и обогащенной 5'-концом». Gene . 200 ( 1– 2): 149– 56. doi :10.1016/S0378-1119(97)00411-3. PMID 9373149.
- Rossi R, Villa A, Negri C, Scovassi I, Ciarrocchi G, Biamonti G, Montecucco A (октябрь 1999 г.). "Последовательность нацеливания репликационной фабрики/сайт связывания PCNA требуются в G(1) для контроля статуса фосфорилирования ДНК-лигазы I". The EMBO Journal . 18 (20): 5745– 54. doi :10.1093/emboj/18.20.5745. PMC 1171641 . PMID 10523317.
- Matsumoto Y, Kim K, Hurwitz J, Gary R, Levin DS, Tomkinson AE, Park MS (ноябрь 1999 г.). «Восстановление зависимой от пролиферирующих клеточных ядерных антигенов репарации апуриновых/апиримидиновых участков с помощью очищенных человеческих белков». Журнал биологической химии . 274 (47): 33703– 8. doi : 10.1074/jbc.274.47.33703 . PMID 10559261.
- Vispé S, Satoh MS (сентябрь 2000 г.). «Образование разрывов двойной цепи ДНК, опосредованное заплаткой для восстановления ДНК, в клетках человека». Журнал биологической химии . 275 (35): 27386– 92. doi : 10.1074/jbc.M003126200 (неактивен 2 декабря 2024 г.). PMID 10827190.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на декабрь 2024 г. ( ссылка )







