Лиганды иосифоса

Лиганд Josiphos представляет собой тип хирального дифосфина , который был модифицирован для специфичности к субстрату ; они широко используются для энантиоселективного синтеза . [2] Они широко используются в асимметрическом катализе. [3]
История

Современный энантиоселективный синтез обычно использует хорошо подобранный гомогенный катализатор для ключевых шагов. Лиганды на этих катализаторах придают хиральность. Семейство привилегированных лигандов Josiphos обеспечивает особенно высокие выходы в энантиоселективном синтезе. [4] [5]
В начале 1990-х годов Антонио Тогни начал изучать в Центральных исследовательских лабораториях Ciba (теперь Novartis ) [6] ранее известные [7] ферроценильные лиганды для Au(I) -катализируемой альдольной реакции . [6] Команда Тогни начала рассматривать дифосфиновые лиганды, а техник Джоси Пулео приготовил первые лиганды с вторичными фосфинами. Команда применила продукты Пулео в синтезе гидрогенизации енамида, катализируемом Ru ; в результате впечатляющего успеха реакция имела ee >99% и частоту оборота (TOF) 0,3 с −1 . [6] [7] Тот же лиганд оказался полезным при производстве (S)-метолахлора , активного ингредиента в наиболее распространенном гербициде в Соединенных Штатах. Синтез требует энантиоселективного гидрирования имина ; После введения катализатора реакция протекает со 100% конверсией, числом оборотов (TON) >7mil и частотой оборотов >0,5 мс −1 . Этот процесс является самым масштабным применением энантиоселективного гидрирования, производя более 10 килотонн/год желаемого продукта с 79% ee [2] [1]
Лиганды Josiphos также служат в неэнантиоселективных реакциях: катализируемая Pd реакция арилхлоридов и арилвинилтозилатов с TON 20 000 или выше, [8] каталитическое карбонилирование, [9] или реакции Гриньяра и Негиши [10] [11] Различные лиганды Josiphos коммерчески доступны по лицензии Solvias. (RS) и его энантиомер обеспечивают более высокие выходы и энантиоселективность, чем диастереомер (R,R). [1]
Ферроценовый каркас оказался универсальным. [12] [13] [14]
Консенсус для наименования заключается в сокращении индивидуального лиганда как (R)-(S)-R 2 PF-PR' 2 . Заместитель в Cp пишется перед F, а R в хиральном центре после F. [2]
Реакции с использованием лигандов Josiphos
Некоторые реакции, которые осуществляются с использованием комплексов M-Josifos в качестве катализатора, перечислены ниже. Другие реакции, в которых могут использоваться лиганды Josiphos: гидрирование связей C=N, C=C и C=O , катализируемое аллильное замещение , гидрокарбоксилирование , присоединение Михаэля , аллильное алкилирование , реакции типа Хека , раскрытие оксабициклического кольца и изомеризация аллиламина . [ требуется ссылка ]
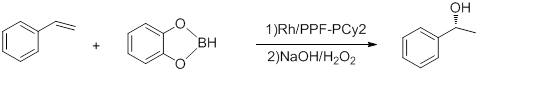
- Гидроборирование стирола

- Проводимая при -78 °C, указанная выше реакция имеет ee до 92% и TOF 5-10 ч −1 . [15] Комплекс Rh-binap Хаяши дает лучший выход. [16]
- Гидроформилирование стирола

- Эта схема реакции дает до 78% ее продукта (R), но низкие TON и TOF 10-210 и 1-14 ч −1 (соответственно). [2] [17]
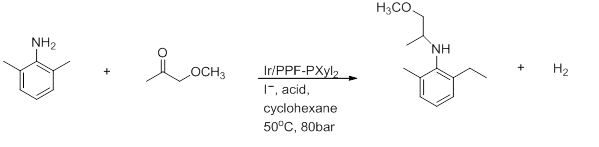
- Восстановительное аминирование

- Выше представлено приготовление (S)-метолахлора . Для хороших выходов и 100%-ной конверсии принципиально необходим растворитель AcOH. [16]
- Гидрирование экзоциклического метилимина

- Этот ключевой шаг в синтезе ингибитора интегразы ВИЧ , Криксивана , является одной из немногих известных гомогенных реакций гидрирования гетероаренов. Объемные группы R повышают производительность катализатора, с 97% ee и TON и TOF 1k и 8 мин −1 соответственно. [18] [19]
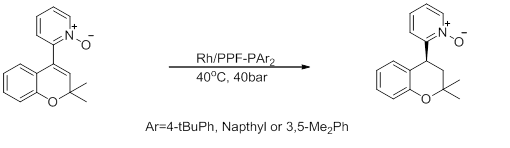
- Асимметричный синтез производных хроманоилпиридина

- Эта реакция, промежуточное соединение в синтезе антигипертензивного и противоалопециального производного хроманоилпиридина, проявляет высокую энантиоселективность, но низкую активность. [20]
Модифицированные лиганды Josiphos
Было описано много вариаций лигандов Josiphos. Одно семейство готовят из амина Уги .

Важным улучшением начальных синтезов стало использование N(CH 3 ) 2 в качестве уходящей группы вместо ацетата , хотя растворитель уксусная кислота дает лучшие выходы. [6]
Дальнейшее чтение
Клевенджер, Эндрю Л.; Столли, Райан М.; Адерибигбе, Джастис; Луи, Джанис (2020). «Тенденции использования бидентатных фосфинов в качестве лигандов в никелевом катализе». Chemical Reviews . 120 (13): 6124– 6196. doi :10.1021/acs.chemrev.9b00682. PMID 32491839.
Ссылки
- ^ abcd Блазер, Ганс Ульрих; Пугин, Бенуа; Шпиндлер , Феликс (2021). «Развлечение (и коммерческий успех) с иосифосом и родственными хиральными лигандами на основе ферроцена». Helvetica Chimica Acta . 104. doi :10.1002/hlca.202000192. S2CID 229427019.
- ^ abcd Блазер, Ганс-Ульрих; Бриден, Вальтер; Пугин, Бенуа; Шпиндлер, Феликс; Штудер, Мартин; Тогни, Антонио (2002). «Лиганды Solvias Josiphos: от открытия до технических применений». Темы по катализу . 19 (1): 3– 16. doi :10.1023/A:1013832630565.
- ^ Блазер, Ганс-Ульрих; Пугин, Бенуа; Шпиндлер, Феликс; Мехия, Эстебан; Тони, Антонио (6 апреля 2011 г.). Чжоу, Ци-Лин (ред.). Йозифосские лиганды: от открытия к техническому применению (1-е изд.). Уайли. стр. 93–136 . doi :10.1002/9783527635207.ch3. ISBN 978-3-527-32704-1.
- ^ Спессард, Гэри О.; Мисслер, Гэри Л. (2010). Металлоорганическая химия (2-е изд.). Нью-Йорк: Oxford University Press. С. 378–379 . ISBN 978-0-19-533099-1.
- ^ Эльшенбройх, Кристофер (2006). Металлоорганические соединения: Третье издание. С.518-519.
- ^ abcd Togni, Antonio (1996-03-27). "Разработка новых хиральных ферроценильных лигандов для асимметричного катализа: личный отчет". CHIMIA . 50 (3): 86. doi : 10.2533/chimia.1996.86 . ISSN 2673-2424.
- ^ ab Ito, Yoshihiko.; Sawamura, Masaya.; Hayashi, Tamio. (октябрь 1986 г.). «Каталитическая асимметричная альдольная реакция: реакция альдегидов с изоцианоацетатом, катализируемая хиральным комплексом ферроценилфосфин-золото(I)». Журнал Американского химического общества . 108 (20): 6405– 6406. doi :10.1021/ja00280a056. ISSN 0002-7863.
- ^ Литтке, Адам Ф.; Фу, Грегори К. (2002-11-15). "Реакции сочетания арилхлоридов, катализируемые палладием". Angewandte Chemie International Edition . 41 (22): 4176– 4211. doi :10.1002/1521-3773(20021115)41:22<4176::AID-ANIE4176>3.0.CO;2-U. PMID 12434342.
- ^ Cai, Chaoxian; Rivera, Nelo R.; Balsells, Jaume; Sidler, Rick R.; McWilliams, J. Christopher; Shultz, C. Scott; Sun, Yongkui (2006-10-01). "Эффективный катализатор для Pd-катализируемого карбонилирования арил аренсульфонатов". Organic Letters . 8 (22): 5161– 5164. doi :10.1021/ol062208g. ISSN 1523-7060. PMID 17048868.
- ^ Лиммерт, Майкл Э.; Рой, Эми Х.; Хартвиг, Джон Ф. (2005-11-01). «Связывание Кумады арильных и винильных тозилатов в мягких условиях». Журнал органической химии . 70 (23): 9364– 9370. doi :10.1021/jo051394l. ISSN 0022-3263. PMID 16268609.
- ^ Vo, Giang D.; Hartwig, John F. (2009-08-12). «Катализируемое палладием сочетание аммиака с арилхлоридами, бромидами, иодидами и сульфонатами: общий метод получения первичных ариламинов». Журнал Американского химического общества . 131 (31): 11049– 11061. doi :10.1021/ja903049z. ISSN 0002-7863. PMC 2823124. PMID 19591470 .
- ^ Колакот, Томас Дж. (2003). «Краткое обновление по применению хиральных ферроценилфосфинов в гомогенном катализе, ведущем к органическому синтезу». Chemical Reviews . 103 (8): 3101– 3118. doi :10.1021/cr000427o. PMID 12914493.
- ^ Блазер, Ганс-Ульрих; Малан, Кристоф; Пьюджин, Бенуа; Шпиндлер, Феликс; Штайнер, Хайнц; Штудер, Мартин (январь 2003 г.). «Селективное гидрирование для тонких химикатов: последние тенденции и новые разработки». Advanced Synthesis & Catalysis . 345 ( 1– 2): 103– 151. doi :10.1002/adsc.200390000. ISSN 1615-4150.
- ^ Чен, В. и Блазер, Х. У. 2008 в Фосфорные лиганды в асимметричном катализе: синтез и применение. (ред. А. Борнер) стр. 359-393
- ^ T. Hayashi, Comprehensive Asymmetric Catalyst, ред. EN Jacobsen, A. Pfaltz и H. Yamamoto, 1999, стр. 247
- ^ ab Blaser, Hans-Ulrich; Buser, Hans-Peter; Jalett, Hans-Peter; Pugin, Benoit; Spindler, Felix (1999-12-31). "Iridium Ferrocenyl Diphosphine Catalyzed Enantioselective Reductive Alkylation of a Hindered Aniline". Synlett . 1999 (Sup. 1): 867– 868. doi :10.1055/s-1999-3106. ISSN 0936-5214. S2CID 99845649.
- ^ Godard, Cyril; Ruiz, Aurora; Claver, Carmen (август 2006 г.). «Систематическое исследование асимметричного метоксикарбонилирования стирола, катализируемого палладиевыми системами, содержащими хиральные ферроценилдифосфиновые лиганды». Helvetica Chimica Acta . 89 (8): 1610– 1622. doi :10.1002/hlca.200690161. ISSN 0018-019X.
- ^ R.Fuchs, EP 803502(1996) присвоен Lonza AG
- ^ Штудер, Мартин; Ведемейер-Эксл, Кристина; Шпиндлер, Феликс; Блазер, Ганс-Ульрих (13 декабря 2000 г.). «Энантиоселективное гомогенное гидрирование монозамещенных пиридинов и фуранов». Monatshefte fuer Chemie/Ежемесячный журнал по химии . 131 (12): 1335–1343 . doi : 10.1007/s007060070013.
- ^ Э. Брогер, Ю. Крамери и П. Джонс, WO 99/01 453. (1997), передано Hoffman-La Roche.