Термодинамическая бета
В статистической термодинамике термодинамическая бета , также известная как холодность , [1] является обратной величиной термодинамической температуры системы: (где T — температура, а k B — постоянная Больцмана ). [2]
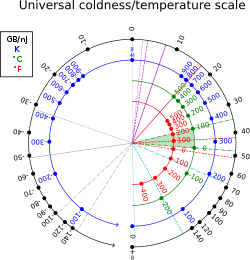
Термодинамическая бета имеет единицы, обратные единицам энергии (в единицах СИ , обратные джоули , ). В нетепловых единицах ее также можно измерять в байтах на джоуль или, что более удобно, в гигабайтах на наноджоуль; [3] 1 К −1 эквивалентен примерно 13 062 гигабайтам на наноджоуль; при комнатной температуре: T = 300 К, β ≈44 ГБ/нДж ≈39 эВ −1 ≈2,4 × 1020 Дж −1 . Коэффициент преобразования составляет 1 ГБ/нДж = Дж − 1 .
Описание
Термодинамическая бета по сути является связью между теорией информации и статистической механикой интерпретации физической системы через ее энтропию и термодинамику , связанную с ее энергией . Она выражает реакцию энтропии на увеличение энергии. Если к системе добавляется небольшое количество энергии, то β описывает количество, которое система будет рандомизировать.
Используя статистическое определение температуры как функции энтропии, функцию холода можно рассчитать в микроканоническом ансамбле по формуле
(т.е. частная производная энтропии S по энергии E при постоянном объеме V и числе частиц N ).
Преимущества
Хотя по концептуальному содержанию β полностью эквивалентна температуре, ее обычно считают более фундаментальной величиной, чем температуру, из-за явления отрицательной температуры , при котором β непрерывна при пересечении нуля, тогда как T имеет сингулярность. [4]
Кроме того, β имеет преимущество в том, что его легче понять причинно-следственно: если к системе добавляется небольшое количество тепла, β представляет собой увеличение энтропии, деленное на увеличение тепла. Температуру трудно интерпретировать в том же смысле, поскольку невозможно «добавить энтропию» к системе, кроме как косвенно, изменяя другие величины, такие как температура, объем или число частиц.
Статистическая интерпретация
Со статистической точки зрения β — числовая величина, связывающая две макроскопические системы в равновесии. Точная формулировка такова. Рассмотрим две системы, 1 и 2, находящиеся в тепловом контакте, с соответствующими энергиями E 1 и E 2 . Мы предполагаем, что E 1 + E 2 = некоторая константа E . Число микросостояний каждой системы будет обозначаться как Ω 1 и Ω 2 . При наших предположениях Ω i зависит только от E i . Мы также предполагаем, что любое микросостояние системы 1, согласующееся с E 1 , может сосуществовать с любым микросостоянием системы 2, согласующимся с E 2 . Таким образом, число микросостояний для объединенной системы равно
Мы выведем β из фундаментального предположения статистической механики :
- Когда объединенная система достигает равновесия, число Ω максимизируется.
(Другими словами, система естественным образом стремится к максимальному числу микросостояний.) Поэтому в состоянии равновесия
Но E 1 + E 2 = E подразумевает
Так
то есть
Вышеприведенное соотношение мотивирует определение β :
Связь статистического представления с термодинамическим представлением
Когда две системы находятся в равновесии, они имеют одинаковую термодинамическую температуру T. Таким образом, интуитивно можно было бы ожидать, что β (определенная через микросостояния) каким-то образом связана с T. Эта связь обеспечивается фундаментальным предположением Больцмана, записанным как
где k B — постоянная Больцмана , S — классическая термодинамическая энтропия, а Ω — число микросостояний. Итак
Подстановка в определение β из статистического определения выше дает
Сравнение с термодинамической формулой
у нас есть
где называется фундаментальной температурой системы и имеет единицы измерения энергии.
История
This section's factual accuracy is disputed. (September 2024) |
Термодинамическая бета была первоначально введена в 1971 году (как Kältefunktion «функция холода») Инго Мюллером , одним из сторонников школы рациональной термодинамики , [5] [6] на основе более ранних предложений о функции «обратной температуры». [1] [7] [ необходим непервичный источник ]
Смотрите также
Ссылки
- ^ ab Day, WA; Gurtin, Morton E. (1969-01-01). "О симметрии тензора проводимости и других ограничениях в нелинейной теории теплопроводности". Архив для Rational Mechanics and Analysis . 33 (1): 26–32. Bibcode :1969ArRMA..33...26D. doi :10.1007/BF00248154. ISSN 1432-0673.
- ^ Meixner, J. (1975-09-01). "Холод и температура". Архив для Rational Mechanics and Analysis . 57 (3): 281–290. Bibcode :1975ArRMA..57..281M. doi :10.1007/BF00280159. ISSN 1432-0673.
- ^ Фраундорф, П. (2003-11-01). «Теплоёмкость в битах». American Journal of Physics . 71 (11): 1142–1151. Bibcode : 2003AmJPh..71.1142F. doi : 10.1119/1.1593658. ISSN 0002-9505.
- ^ Киттель, Чарльз; Кремер, Герберт (1980), Теплофизика (2-е изд.), Соединенные Штаты Америки: WH Freeman and Company, ISBN 978-0471490302
- ^ Мюллер, Инго (1971). «Die Kältefunktion, eine Universelle Funktion in der Thermodynamik wärmeleitender Flüssigkeiten» [Функция холода, универсальная функция в термодинамике теплопроводных жидкостей]. Архив рациональной механики и анализа . 40 : 1–36. дои : 10.1007/BF00281528.
- ^ Мюллер, Инго (1971). «Холодность, универсальная функция термоупругих тел». Архив для Rational Mechanics and Analysis . 41 (5): 319–332. Bibcode : 1971ArRMA..41..319M. doi : 10.1007/BF00281870.
- ^ Касл, Дж.; Эммениш, У.; Хенкес, Р.; Миллер, Р.; Рейн, Дж. (1965). Наука по градусам: температура от нуля до нуля . Нью-Йорк: Walker and Company.

![{\displaystyle [\beta ]={\textrm {J}}^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/95d75d6e2e60e9f106f17e91bd18a413a3a9d6e9)














