Гетероядерная одноквантовая когерентная спектроскопия
Эксперимент по гетероядерной одноквантовой когерентности или гетероядерной одноквантовой корреляции , обычно сокращенно HSQC , часто используется в ЯМР- спектроскопии органических молекул и имеет особое значение в области белкового ЯМР . Эксперимент был впервые описан Джеффри Боденхаузеном и DJ Ruben в 1980 году. [1] Полученный спектр является двумерным (2D) с одной осью для протона ( 1 H), а другой для гетероядра ( атомного ядра, отличного от протона), которое обычно является 13 C или 15 N. Спектр содержит пик для каждого уникального протона, присоединенного к рассматриваемому гетероядру. 2D HSQC также можно комбинировать с другими экспериментами в экспериментах ЯМР более высокой размерности, такими как NOESY-HSQC или TOCSY-HSQC.
Общая схема
Эксперимент HSQC является высокочувствительным экспериментом 2D-ЯМР и был впервые описан в системе 1 H— 15 N, но также применим к другим ядрам, таким как 1 H— 13 C и 1 H— 31 P. Основная схема этого эксперимента включает передачу намагниченности от протона ко второму ядру, которое может быть 15 N, 13 C или 31 P, через шаг INEPT (нечувствительные ядра, усиленные переносом поляризации). После временной задержки ( t 1 ) намагниченность передается обратно протону через шаг ретро-INEPT, а затем сигнал регистрируется. В HSQC регистрируется серия экспериментов, в которых временная задержка t 1 увеличивается. Сигнал 1 H обнаруживается в прямо измеренном измерении в каждом эксперименте, в то время как химический сдвиг 15 N или 13 C регистрируется в косвенном измерении, которое формируется из серии экспериментов.
HSQC в ЯМР-спектроскопии белков
1ЧАС-15N HSQC

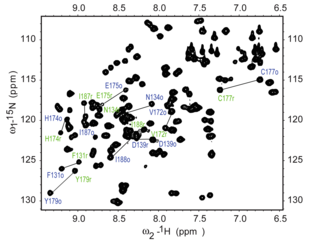
Эксперимент 15 N HSQC является одним из наиболее часто регистрируемых экспериментов в ЯМР белков. Эксперимент HSQC может быть выполнен с использованием естественного содержания изотопа 15 N , но обычно для ЯМР белков используются изотопно-меченые белки. Такие меченые белки обычно производятся путем экспрессии белка в клетках, выращенных в среде, меченой 15 N.
Каждый остаток белка , за исключением пролина , имеет амидный протон, присоединенный к азоту в пептидной связи . HSQC обеспечивает корреляцию между азотом и амидным протоном, и каждый амид дает пик в спектрах HSQC. Поэтому каждый остаток (за исключением пролина) может давать наблюдаемый пик в спектрах, хотя на практике не все пики всегда видны из-за ряда факторов. Обычно N-концевой остаток (который имеет присоединенную группу NH 3 + ) нелегко наблюдать из-за обмена с растворителем. [3] В дополнение к амидным резонансам основной цепи, боковые цепи с протонами, связанными с азотом, также будут давать пики.
В типичном спектре HSQC пики NH 2 из боковых цепей аспарагина и глутамина появляются в виде дублетов в правом верхнем углу, а меньший пик может появляться поверх каждого пика из-за обмена дейтерием из D 2 O , обычно добавляемого к образцу ЯМР, что придает этим пикам боковых цепей характерный вид. Пики аминов боковых цепей от триптофана обычно смещены вниз по полю и появляются около нижнего левого угла. Пики амидов основной цепи глицина обычно появляются около верхней части спектра.
Спектр 15 N HSQC обычно является первым гетероядерным спектром, полученным для назначения резонансов, где каждый пик амида назначен определенному остатку в белке. Если белок сложен, пики обычно хорошо рассеяны, и большинство отдельных пиков можно различить. Если есть большой кластер сильно перекрывающихся пиков вокруг середины спектра, это будет указывать на присутствие значительных неструктурированных элементов в белке. В таких случаях, когда есть сильное перекрытие резонансов, назначение резонансов в спектрах может быть затруднено. Назначение спектра HSQC требует других экспериментов, в идеале с использованием экспериментов по тройному резонансу с белками, мечеными 15 N и 13 C, которые обеспечивают последовательные связи между остатками, так что резонансы могут быть связаны с определенными остатками и последовательно назначены. Назначение спектра необходимо для осмысленной интерпретации более продвинутых экспериментов ЯМР, таких как определение структуры и анализ релаксации .
Химикаты, меченые изотопом 15 N , относительно недороги, а 15 N HSQC является чувствительным экспериментом, в котором спектр может быть получен за относительно короткое время, поэтому 15 N HSQC часто используется для скрининга кандидатов на их пригодность для определения структуры с помощью ЯМР, а также для оптимизации условий образца. Трудоемкий процесс определения структуры обычно не выполняется, пока не будет получен хороший спектр HSQC. Эксперимент HSQC также полезен для обнаружения интерфейса связывания во взаимодействии белок-белок, а также взаимодействий с лигандами , такими как лекарственные средства. Сравнивая HSQC свободного белка с тем, который связан с лигандом, можно наблюдать изменения в химических сдвигах некоторых пиков, и эти пики, вероятно, лежат на поверхности связывания, где связывание нарушило их химические сдвиги. [ 4] 15 N HSQC также может использоваться в релаксационном анализе при изучении молекулярной динамики белков, определении константы ионизации и других исследованиях.
1ЧАС-13C HSQC
Этот эксперимент обеспечивает корреляции между углеродом и присоединенными к нему протонами. Обычно используется версия с постоянным временем (CT) 1 H— 13 C HSQC, поскольку она обходит проблему расщепления сигнала из-за гомоядерных связей 13 C— 13 C J , что снижает спектральное разрешение. [5] «Постоянное время» относится ко всему периоду эволюции между двумя шагами INEPT, который в этом эксперименте сохраняется постоянным. Если этот период эволюции установлен как обратный константе связи J , то знак намагниченности тех углеродов, к которым присоединено нечетное число алифатических углеродов, будет противоположен знаку намагниченности тех углеродов, к которым присоединено четное число. Например, если C β лейцина появляется как положительный пик (присоединено 2 алифатических углерода), то C γ (присоединено 3 алифатических углерода) и C α (присоединен 1 алифатический углерод) будут выглядеть отрицательными.
HSQC в ЯМР липидов
1ЧАС-31P HSQC
Использование 1 H— 31 P HSQC относительно необычно в липидомике, однако использование 31 P в липидомике относится к 1990-м годам. [6] Использование этого метода ограничено в отношении масс-спектрометрии из-за его необходимости в гораздо большем размере образца, однако сочетание 1 H— 31 P HSQC с масс-спектрометрией рассматривается как комплексный подход к липидомике, и методы «двойной спектроскопии» становятся доступными. [7]
Смотрите также
Ссылки
- ^ Боденхаузен, Г.; Рубен, DJ (1980). «Естественное содержание азота-15 ЯМР с помощью усиленной гетероядерной спектроскопии». Chemical Physics Letters . 69 (1): 185– 189. Bibcode : 1980CPL....69..185B. doi : 10.1016/0009-2614(80)80041-8. S2CID 96730420.
- ^ Wu, Bin; Skarina, Tatiana, Yee, Adelinda, Jobin, Marie-Claude, DiLeo, Rosa, Semesi, Anthony, Fares, Christophe, Lemak, Alexander, Coombes, Brian K., Arrowsmith, Cheryl H., Singer, Alexander U., Savchenko, Alexei, Stebbins, C. Erec (июнь 2010 г.). "Эффекторы NleG типа 3 из энтерогеморрагической Escherichia coli являются U-Box E3 убиквитиновыми лигазами". PLOS Pathogens . 6 (6): e1000960. doi : 10.1371/journal.ppat.1000960 . PMC 2891834. PMID 20585566 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Стивен М. Паскаль (2008). NMR Primer: An HSQC-based Approach with Vector Animations. IM Publications LLP. С. 29–31 . ISBN 978-1901019087.
- ^ Уильямсон, Майк П. (2013-08-01). «Использование возмущения химического сдвига для характеристики связывания лиганда». Прогресс в области ядерно-магнитной резонансной спектроскопии . 73 : 1– 16. Bibcode :2013PNMRS..73....1W. doi :10.1016/j.pnmrs.2013.02.001. ISSN 0079-6565. PMID 23962882.
- ^ Geerten W. Vuister; Ad Bax (1992). "Повышение разрешения и спектральное редактирование однородно обогащенных 13CEnriched белков путем гомоядерного широкополосного разъединения 13C" (PDF) . Журнал магнитного резонанса . 98 (2): 428– 435. Bibcode :1992JMagR..98..428V. doi :10.1016/0022-2364(92)90144-v.
- ^ Bosco, M.; Culeddu, N.; Toffanin, R.; Pollesello, P. (1997). «Органические системы растворителей для анализа ядерного магнитного резонанса 31P лецитиновых фосфолипидов: применение в экспериментах по двумерной гетероядерной множественной квантовой когерентности, детектируемой с помощью градиента 1H». Аналитическая биохимия . 245 (1): 38– 47. doi :10.1006/abio.1996.9907. PMID 9025966.
- ^ Фурс, Сэмюэл; Фернандес-Твинн, Дениз; Дженкинс, Бенджамин; Мик, Клэр Л.; Уильямс, Хью Э.; Смит, Гордон К. С.; Чарнок-Джонс, Д. Стивен; Озанна Сьюзан, Э.; Коулман, Альберт (2020). «Высокопроизводительная платформа для детального липидомного анализа ряда тканей мыши и человека». Аналитическая и биоаналитическая химия . 412 (12): 2851– 2862. doi : 10.1007 /s00216-020-02511-0 . PMC 7196091. PMID 32144454.
Общие ссылки
- Спектроскопия ЯМР белков: принципы и практика (1995) Джон Каванах, Уэйн Дж. Фейрброзер, Артур Дж. Палмер III, Николас Дж. Скелтон, Academic Press
Внешние ссылки
- ЯМР-спектры белков ЯМР-спектры белков