Дефицит галактозоэпимеразы
Эта статья нуждается в дополнительных цитатах для проверки . ( май 2020 г. ) |
| Дефицит галактозоэпимеразы | |
|---|---|
| Другие имена | Дефицит уридиндифосфатгалактозо-4-эпимеразы |
 | |
| Уридиндифосфатглюкоза | |
Дефицит галактозоэпимеразы , также известный как дефицит GALE , галактоземия III [1] и дефицит УДФ-галактозо-4-эпимеразы [2] , является редкой аутосомно - рецессивной формой галактоземии , связанной с дефицитом фермента галактозоэпимеразы .
Симптомы и признаки
Симптомы врожденной галактоземии III типа проявляются с рождения, но различаются по степени тяжести в зависимости от того, присутствует ли периферическая или генерализованная форма заболевания. Симптомы могут включать: [3] [4]
- Детская желтуха
- Инфантильная гипотония
- Дисморфические черты
- Сенсоневральная потеря слуха
- Нарушение роста
- Когнитивные нарушения
- Истощение клеток Пуркинье мозжечка
- Яичниковая недостаточность (ПНЯ) и гипертрофический гипергонадизм
- Печеночная недостаточность
- Почечная недостаточность
- Спленомегалия
- Катаракта
Исследования симптомов галактоземии типа III в основном носят описательный характер, а точные патогенные механизмы остаются неизвестными. Это во многом связано с отсутствием функциональных животных моделей классической галактоземии. Недавнее развитие мутанта Drosophila melanogaster GALE, демонстрирующего симптомы галактоземии, может дать многообещающую будущую модель животных. [3]
Генетика

Дефицит галактозоэпимеразы является аутосомно-рецессивным заболеванием, [5] что означает, что дефектный ген расположен на аутосоме , и для наследования заболевания требуются две копии дефектного гена — по одной от каждого родителя. Родители человека с аутосомно-рецессивным заболеванием оба несут одну копию дефектного гена, но обычно не испытывают никаких признаков или симптомов заболевания. [ необходима цитата ]
Генетическая основа
Были идентифицированы различные мутации человеческого GALE, приводящие к галактоземии типа III. [6] Функциональный анализ этих мутантных изоформ GALE предполагает, что сниженная каталитическая эффективность и повышенная вероятность протеолитического переваривания действуют как причинные факторы при галактоземии типа III. [6]
| Мутированный остаток | Биохимический эффект | Клинические проявления |
|---|---|---|
| В94М, К257Р, Л313М, Р335Н | Сильно нарушенное число оборотов и константа специфичности | Тяжелая генерализованная галактоземия. [3] |
| S81R, T150M, P293L | Легкое ухудшение числа оборотов | Промежуточная галактоземия. [6] |
| L183P, D103G, G90E, N34S | Значительно нарушены число оборотов и константа специфичности; повышено протеолитическое переваривание. | Тяжелая генерализованная галактоземия. [3] |
Биохимическая основа
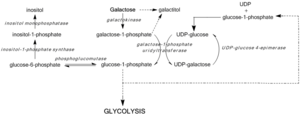
Дефицит GALE подавляет регенерацию UDP-глюкозы, предотвращая образование глюкозо-1-фосфата и приводя к накоплению галактозы и галактозо-1-фосфата. Было показано, что высокие уровни галактозо-1-фосфата мешают активности фосфоглюкомутазы [7] , гликогенфосфорилазы [8] , UDP-гликопирофосфорилазы [9] в бактериальных моделях и in vitro , однако механизмы токсичности in vivo еще не подтверждены. [3] Независимо от этого, медианные уровни галактозо-1-фосфата действуют как наиболее точные предикторы тяжести симптомов , связанных с галактоземией III типа. [10]
Блокировка пути Лелуара дефицитом или дисфункцией GALE активирует альтернативные пути метаболизма глюкозы и приводит к образованию галактитола и галактоната. Галактитол метаболизируется пентозофосфатным путем и не считается токсичным. [11] Однако галактитол может накапливаться в волокнах хрусталика, нарушая проницаемость эпителиальных клеток хрусталика и приводя к гибели клеток и образованию катаракты. [12] Дефицит GALE также нарушает биосинтез гликолипидов и гликопротеинов из-за снижения продукции UDP-GalNAc из UDP-GlcNAc. [3]
Диагноз
Скрининг на повышенный уровень галактозы может выявить дефицит или дисфункцию GALE у младенцев, а исследования мутаций GALE доступны в клинических условиях. [13]
Классификация
Существует 2 формы дефицита эпимеразы: доброкачественный дефицит эритроцитов и тяжелая недостаточность печени. Тяжелая форма похожа на галактоземию . [ необходима цитата ]
Уход
Лица с галактоземией типа III должны придерживаться диеты с ограничением лактозы и галактозы, исключающей молочные продукты и слизистые растения. [4] Диетическое ограничение является единственным доступным в настоящее время лечением дефицита GALE. Однако, поскольку метаболизм гликопротеинов и гликолипидов генерирует эндогенную галактозу, галактоземия типа III не может быть решена исключительно с помощью диетического ограничения. [3]
Ссылки
- ^ Онлайн Менделевское наследование у человека (OMIM): Дефицит галактозоэпимеразы - 230350
- ^ Интернет-менделевское наследование у человека (OMIM): UDP-галактозо-4-эпимераза - 606953
- ^ abcdefgh Lai K, Elsas LJ, Wierenga KJ (ноябрь 2009 г.). «Токсичность галактозы у животных». IUBMB Life . 61 (11): 1063–74 . doi :10.1002/iub.262. PMC 2788023. PMID 19859980 .
- ^ ab Walter JH, Roberts RE, Besley GT, Wraith JE, Cleary MA, Holton JB, MacFaul R (апрель 1999 г.). "Общий дефицит уридиндифосфатгалактозо-4-эпимеразы". Arch. Dis. Child . 80 (4): 374– 6. doi :10.1136/adc.80.4.374. PMC 1717903 . PMID 10086948.
- ^ Park HD, Park KU, Kim JQ, Shin CH, Yang SW, Lee DH, Song YH, Song J (ноябрь 2005 г.). «Молекулярная основа дефицита UDP-галактоза-4-эпимеразы (GALE) при галактоземии у корейских пациентов». Генетика в медицине . 7 (9): 646– 9. doi : 10.1097/01.gim.0000194023.27802.2d . PMID 16301867.
- ^ abc Timson DJ (декабрь 2005 г.). «Функциональный анализ мутаций, вызывающих заболевания, в человеческой UDP-галактозо-4-эпимеразе». FEBS J . 272 (23): 6170– 7. doi : 10.1111/j.1742-4658.2005.05017.x . PMID 16302980.
- ^ de Jongh WA, Bro C, Ostergaard S, Regenberg B, Olsson L, Nielsen J (октябрь 2008 г.). «Роль галактитола, галактозо-1-фосфата и фосфоглюкомутазы в токсичности, вызванной галактозой, у Saccharomyces cerevisiae ». Biotechnol. Bioeng . 101 (2): 317–26 . doi :10.1002/bit.21890. PMID 18421797. S2CID 205497901.
- ^ Maddaiah VT, Madsen NB (сентябрь 1966 г.). «Кинетика очищенной фосфорилазы печени». J. Biol. Chem . 241 (17): 3873– 81. doi : 10.1016/S0021-9258(18)99788-7 . PMID 5920799.
- ^ Lai K, Elsas LJ (май 2000). «Сверхэкспрессия человеческой UDP-глюкозопирофосфорилазы спасает дрожжи с дефицитом галактозо-1-фосфатуридилтрансферазы». Biochem. Biophys. Res. Commun . 271 (2): 392– 400. doi :10.1006/bbrc.2000.2629. PMID 10799308.
- ^ Guerrero NV, Singh RH, Manatunga A , Berry GT, Steiner RD, Elsas LJ (декабрь 2000 г.). «Факторы риска преждевременной недостаточности яичников у женщин с галактоземией». J. Pediatr . 137 (6): 833–41 . doi :10.1067/mpd.2000.109148. PMID 11113841.
- ^ Wehrli SL, Berry GT, Palmieri M, Mazur A, Elsas L, Segal S (декабрь 1997 г.). «Галактонат в моче у пациентов с галактоземией: количественное определение с помощью ядерно-магнитной резонансной спектроскопии». Pediatr. Res . 42 (6): 855–61 . doi : 10.1203/00006450-199712000-00022 . PMID 9396569.
- ^ Киношита Дж. Х., Дворник Д., Крамл М., Габбей К. Х. (июнь 1968 г.). «Влияние ингибитора альдозоредуктазы на хрусталик глаза кролика, подвергнутый воздействию галактозы». Biochim. Biophys. Acta . 158 (3): 472– 5. doi :10.1016/0304-4165(68)90305-x. PMID 5660111.
- ^ Alano A, Almashanu S, Chinsky JM, Costeas P, Blitzer MG, Wulfsberg EA, Cowan TM (июнь 1998 г.). «Молекулярная характеристика уникального пациента с эпимеразно-дефицитной галактоземией». J. Inherit. Metab. Dis . 21 (4): 341– 50. doi : 10.1023/A:1005342306080 . PMID 9700591. S2CID 27586949.
