Трансгенерационное эпигенетическое наследование
Эта статья требует внимания эксперта по генетике . Подробности смотрите на странице обсуждения . ( Январь 2025 ) |

Трансгенерационное эпигенетическое наследование — это предполагаемая передача эпигенетических маркеров и модификаций от одного поколения к нескольким последующим поколениям без изменения первичной структуры ДНК . [1] Таким образом, регуляция генов посредством эпигенетических механизмов может быть наследуемой; количество транскриптов и продуцируемых белков может быть изменено унаследованными эпигенетическими изменениями. Однако для того, чтобы эпигенетические метки были наследуемыми, они должны возникать в гаметах у животных, но поскольку у растений отсутствует определенная зародышевая линия и они могут размножаться, эпигенетические метки в любой ткани могут быть наследуемыми. [2]
Наследование эпигенетических меток в непосредственном поколении называется межпоколенческим наследованием. [3] У самцов мышей эпигенетический сигнал сохраняется в течение поколения F1. [4] У самок мышей эпигенетический сигнал сохраняется в течение поколения F2 в результате воздействия зародышевой линии в утробе матери. [4] Многие эпигенетические сигналы теряются после поколения F2/F3 и больше не наследуются, поскольку последующие поколения не подвергались воздействию той же среды, что и родительские поколения. [3] Сигналы, которые сохраняются после поколения F2/F3, называются трансгенерационным эпигенетическим наследованием (TEI), поскольку первоначальные экологические стимулы привели к наследованию эпигенетических модификаций. [5] Существует несколько механизмов TEI, которые, как было показано, влияют на перепрограммирование зародышевой линии, такие как трансгенерационное увеличение восприимчивости к болезням, мутациям и стрессовому наследованию. Во время перепрограммирования зародышевой линии и раннего эмбриогенеза у мышей метки метилирования удаляются, чтобы позволить начаться развитию, но метка метилирования преобразуется в гидроксиметилцитозин, чтобы он был распознан и метилирован, как только эта область генома больше не используется, [6] что служит памятью для этой метки TEI. Поэтому в лабораторных условиях унаследованные метильные метки удаляются и восстанавливаются, чтобы гарантировать, что TEI все еще происходит. Однако наблюдение TEI в диких популяциях все еще находится в зачаточном состоянии, поскольку лабораторные исследования позволяют использовать более управляемые системы. [7]
Факторы окружающей среды могут индуцировать эпигенетические метки (эпигенетические метки) для некоторых эпигенетически обусловленных признаков. [1] Они могут включать, но не ограничиваться, изменениями температуры, доступностью ресурсов, воздействием загрязняющих веществ, химикатов и эндокринных разрушителей. [8] Дозировка и уровни воздействия могут влиять на степень влияния факторов окружающей среды на эпигеном и его влияние на последующие поколения. Эпигенетические метки могут приводить к широкому спектру эффектов, включая незначительные фенотипические изменения в сложных заболеваниях и расстройствах. [8] Сложные сигнальные пути клеток многоклеточных организмов, таких как растения и люди, могут сильно затруднить понимание механизмов этого унаследованного процесса. [9]
Эпигенетические категории
Существуют механизмы, посредством которых воздействие окружающей среды вызывает эпигенетические изменения, влияя на регуляцию и экспрессию генов. Известны четыре общие категории эпигенетических модификаций.
- самоподдерживающиеся метаболические петли, в которых мРНК или белковый продукт гена стимулирует транскрипцию гена; например, ген Wor1 у Candida albicans ;
- Структурное шаблонирование: структуры реплицируются с использованием шаблона или структуры каркаса родителя. Это может включать, но не ограничиваться, ориентацией и архитектурой структур цитоскелета, ресничек и жгутиков. Инфузории являются хорошим примером этого типа модификации. В эксперименте Бейссона и Зоннеборна в 1985 году было показано на Paramecium , что если часть ресничек удалить и инвертировать, то потомство этого Paramecium также будет демонстрировать измененную структуру ресничек в течение нескольких поколений. [10] Другой пример можно увидеть в прионах , особых белках, которые способны изменять структуру нормальных белков, чтобы они соответствовали их собственной. Прионы используют себя в качестве шаблона, а затем редактируют сворачивание нормальных белков, чтобы они соответствовали их собственному шаблону сворачивания. Изменения в сворачивании белка приводят к изменению функции нормального белка. Эта передача программирования может также изменять хроматин и гистон ДНК и может передаваться через цитозоль от родителя к потомству во время мейоза. [10]
- Модификации гистонов , при которых регулируется структура хроматина и его транскрипционное состояние. ДНК завернута в комплекс ДНК-белок, называемый хроматином, в ядре эукариотических клеток. [11] Хроматин состоит из ДНК и нуклеосом, которые объединяются, образуя гистоновый октамер. [12] N- и C-концы гистоновых белков посттрансляционно модифицируются путем удаления или добавления ацетил (ацетилирование), фосфат (фосфорилирование), метил (метилирование), убиквитин (убиквитинирование) и убиквитин-подобных модификаторов (SUMOylating). [11] Модификации гистонов могут быть трансгенерационными эпигенетическими сигналами. Например, триметилирование гистона H3K4 (H34me3) и сеть генов метаболизма липидов взаимодействуют, увеличивая транскрипционный ответ на эффекты ожирения TEI. [13] TEI также можно наблюдать у эмбрионов дрозофилы при воздействии теплового стресса на протяжении поколений. [4] Индуцированный тепловой стресс привел к фосфорилированию ATF-2 (dATF-2), который необходим для сборки гетерохроматина. [14] Это эпигенетическое событие поддерживалось на протяжении нескольких поколений, но со временем dATF-2 вернулся в свое нормальное состояние. [14]
- Некодирующие и кодирующие РНК, в которых различные классы РНК участвуют в TEI через материнские запасы мРНК, трансляцию мРНК (миРНК) и малые цепи РНК, мешающие транскрипции (пиРНК и siРНК) через пути РНК-интерференции (РНКi). [3] Наблюдается увеличение числа исследований, сообщающих о вкладе некодирующих РНК в TEI. Например, измененная микроРНК у мышей с ранней травмой. [15] Мыши с ранней травмой с непредсказуемым отделением от матери и материнским стрессом (MSUS) использовались в качестве модели для выявления эффектов измененной микроРНК в сперме. [16] У мышей MSUS были затронуты поведенческие реакции, снижены уровни инсулина и глюкозы в крови. [16] Примечательно, что эти эффекты были более серьезными в поколениях F2 и F3. Экспрессия микроРНК у мышей MSUS была снижена в мозге, сыворотке и сперме поколения F1. [16] Однако miRNA не была изменена в сперме поколения F2, а miRNA были нормальными в поколении F3. [16] Это подтверждает, что первоначальные изменения miRNA в сперме переносятся на эпигенетические метки для поддержания передачи. [17] У C.elegans индуцируется голодание, при котором выживание зависит от механизмов пути РНК-интерференции, репрессии микроРНК и регуляции малых РНК. [18] Таким образом, запоминание истории питания наследуется из поколения в поколение. [18]
Наследование эпигенетических меток
Хотя существуют различные формы наследования эпигенетических маркеров, наследование эпигенетических маркеров можно обобщить как распространение эпигенетической информации посредством зародышевой линии. [19] Более того, эпигенетическая изменчивость обычно принимает одну из четырех общих форм, хотя есть и другие формы, которые еще предстоит выяснить. В настоящее время самоподдерживающиеся петли обратной связи, пространственное шаблонирование, маркировка хроматина и РНК-опосредованные пути модифицируют эпигены отдельных клеток. Эпигенетическая изменчивость внутри многоклеточных организмов является либо эндогенной, либо экзогенной. [20] Эндогенная генерируется посредством межклеточной сигнализации (например, во время дифференциации клеток на ранней стадии развития), тогда как экзогенная является клеточным ответом на сигналы окружающей среды. [ необходима цитата ]
Удаление против сохранения
У организмов, размножающихся половым путем, большая часть эпигенетических модификаций внутри клеток сбрасывается во время мейоза (например, метки в локусе FLC, контролирующие яровизацию растений [21] ), хотя было показано, что некоторые эпигенетические ответы сохраняются (например, метилирование транспозона у растений [21] ). Дифференциальное наследование эпигенетических меток из-за основных материнских или отцовских предубеждений в механизмах удаления или сохранения может привести к назначению эпигенетической причинности некоторым эффектам родительского происхождения у животных [22] и растений. [23]
Перепрограммирование
У млекопитающих эпигенетические метки стираются в течение двух фаз жизненного цикла. Во-первых, сразу после оплодотворения, а во-вторых, в развивающихся первичных половых клетках, предшественниках будущих гамет. [24] Во время оплодотворения мужские и женские гаметы соединяются в разных состояниях клеточного цикла и с разной конфигурацией генома. Эпигенетические метки самца быстро разбавляются. Во-первых, протамины, связанные с мужской ДНК, заменяются гистонами из цитоплазмы самки , большинство из которых ацетилированы либо из-за более высокого содержания ацетилированных гистонов в цитоплазме самки, либо из-за предпочтительного связывания мужской ДНК с ацетилированными гистонами. [25] [26] Во-вторых, мужская ДНК систематически деметилируется во многих организмах, [27] [28], возможно, через 5-гидроксиметилцитозин . Однако некоторые эпигенетические метки, в частности метилирование материнской ДНК, могут избежать этого перепрограммирования, что приводит к родительскому импринтингу. [ необходима ссылка ]
В первичных половых клетках (PGC) происходит более обширное стирание эпигенетической информации. Однако некоторые редкие сайты также могут избегать стирания метилирования ДНК. [29] Если эпигенетические метки избегают стирания во время как зиготических , так и PGC событий перепрограммирования, это может сделать возможным трансгенерационное эпигенетическое наследование. [ необходима цитата ]
Признание важности эпигенетического программирования для установления и фиксации идентичности клеточной линии во время раннего эмбриогенеза в последнее время стимулировало интерес к искусственному удалению эпигенетического программирования. [30] Эпигенетические манипуляции могут позволить восстановить тотипотентность в стволовых клетках или клетках в целом, тем самым обобщая регенеративную медицину [ необходима ссылка ] .
Удержание
Клеточные механизмы могут допускать совместную передачу некоторых эпигенетических меток. Во время репликации ДНК-полимеразы, работающие на лидирующих и отстающих цепях, связаны с фактором процессивности ДНК, пролиферирующим ядерным антигеном клеток (PCNA), который также участвует в формировании паттерна и перекрестных помехах нитей, что обеспечивает точность копирования эпигенетических меток. [31] [32] Работа над точностью копирования модификации гистонов осталась на стадии моделирования, но ранние попытки показывают, что модификации новых гистонов копируются по образцу старых гистонов и что новые и старые гистоны случайным образом распределяются между двумя дочерними цепями ДНК. [33] Что касается передачи следующему поколению, многие метки удаляются, как описано выше. Новые исследования находят закономерности эпигенетической консервации между поколениями. Например, центромерные сателлиты устойчивы к деметилированию. [34] Механизм, ответственный за эту консервацию, неизвестен, хотя некоторые данные свидетельствуют о том, что метилирование гистонов может способствовать этому. [34] [35] Также была выявлена дисрегуляция времени метилирования промотора, связанная с дисрегуляцией экспрессии генов у эмбриона. [36]
Разлагаться
В то время как скорость мутации в данном 100-основном гене может составлять 10−7 на поколение, эпигены могут «мутировать» несколько раз за поколение или могут быть фиксированными на протяжении многих поколений. [37] Это поднимает вопрос: являются ли изменения в частотах эпигенов эволюцией? Быстро затухающие эпигенетические эффекты на фенотипы (т.е. длящиеся менее трех поколений) могут объяснить некоторые остаточные вариации в фенотипах после того, как генотип и окружающая среда учтены. Однако различение этих краткосрочных эффектов от эффектов материнской среды на раннем онтогенезе остается сложной задачей. [ необходима цитата ]
Примеры ТЭИ
Относительная важность генетического и эпигенетического наследования является предметом споров. Хотя были опубликованы сотни примеров эпигенетической модификации фенотипов, мало исследований было проведено вне лабораторных условий. Поэтому взаимодействие генов с окружающей средой не может быть выведено, несмотря на центральную роль среды в естественном отборе. Множественные эпигенетические факторы могут влиять на состояние генов и изменять эпигенетическое состояние. Из-за многовариантной природы факторов окружающей среды исследователям трудно определить точную причину эпигенетических изменений вне лабораторных условий. [38]
В растениях
Исследования, касающиеся трансгенерационного эпигенетического наследования у растений, были опубликованы еще в 1950-х годах. [39] Одним из самых ранних и наиболее хорошо охарактеризованных примеров этого является парамутация b1 у кукурузы. [39] [40] [41] [42] [43] [44 ] [45] [46] Ген b1 кодирует основной фактор транскрипции спираль-петля-спираль , который участвует в пути производства антоциана . Когда ген b1 экспрессируется, растение накапливает антоциан в своих тканях, что приводит к фиолетовой окраске этих тканей. Аллель BI (от B-Intense) имеет высокую экспрессию b1, что приводит к темной пигментации тканей оболочки и шелухи, в то время как аллель B' (произносится как B-prime) имеет низкую экспрессию b1, что приводит к низкой пигментации в этих тканях. [47] Когда гомозиготные родители BI скрещиваются с гомозиготными B', все полученное потомство F1 демонстрирует низкую пигментацию, что обусловлено подавлением гена b1. [39] [47] Неожиданно, когда растения F1 самоскрещиваются, все полученное поколение F2 демонстрирует низкую пигментацию и имеет низкие уровни экспрессии b1. Более того, когда любое растение F2 (включая те, которые генетически гомозиготны по BI) скрещиваются с гомозиготными BI, все потомство будет демонстрировать низкую пигментацию и экспрессию b1. [39] [47] Отсутствие темнопигментированных особей в потомстве F2 является примером неменделевского наследования , и дальнейшие исследования показали, что аллель BI преобразуется в B' через эпигенетические механизмы. [41] [42] Аллели B' и BI считаются эпиаллелями , поскольку они идентичны на уровне последовательности ДНК, но различаются по уровню метилирования ДНК , продукции siRNA и хромосомным взаимодействиям в ядре. [45] [48] [44] [43] Кроме того, растения, дефектные по компонентам пути РНК-направленного метилирования ДНК, показывают повышенную экспрессию b1 у особей B', аналогичную таковой у BI, однако, как только эти компоненты восстанавливаются, растение возвращается в состояние низкой экспрессии. [46] [49] [50] [51] Хотя наблюдалось спонтанное преобразование из BI в B', реверсия из B' в BI (из зеленого в фиолетовый) никогда не наблюдалась на протяжении 50 лет и тысяч растений как в тепличных, так и в полевых экспериментах. [52]
Также сообщалось о примерах трансгенерационного эпигенетического наследования, вызванного окружающей средой, у растений. В одном случае растения риса, которые были подвергнуты обработке с имитацией засухи, показали повышенную устойчивость к засухе после 11 поколений воздействия и размножения путем односемянного происхождения по сравнению с растениями, не подвергавшимися засухе. Различия в устойчивости к засухе были связаны с направленными изменениями уровней метилирования ДНК по всему геному, что позволяет предположить, что вызванные стрессом наследственные изменения в моделях метилирования ДНК могут быть важны для адаптации к повторяющимся стрессам. В другом исследовании растения, которые подвергались умеренному воздействию гусениц в течение нескольких поколений, показали повышенную устойчивость к травоядности в последующих поколениях (измеряемую по сухой массе гусениц) по сравнению с растениями, не имевшими давления травоядных. Это повышение устойчивости к травоядным сохранялось после поколения роста без какого-либо воздействия травоядных, что позволяет предположить, что реакция передавалась из поколения в поколение. В отчете сделан вывод о том, что компоненты пути РНК-направленного метилирования ДНК участвуют в повышенной устойчивости из поколения в поколение. Трансгенерационное эпигенетическое наследование также наблюдалось у полиплоидных растений. Было показано, что генетически идентичные реципрокные гибридные триплоиды F1 демонстрируют трансгенерационные эпигенетические эффекты на развитие жизнеспособных семян F2. [ необходима цитата ]
Было показано, что на растениях дикого редиса ( Raphanus raphanistrum ) TEI может быть вызван , когда растения подвергаются воздействию хищников, таких как Pieris rapae , гусеница капустной белянки. Растения редиса увеличат производство щетинистых волосков листьев и токсичного горчичного масла в ответ на хищничество гусениц. Повышенные уровни также будут наблюдаться в следующем поколении. Снижение уровня хищничества также приводит к уменьшению волосков листьев и токсинов, вырабатываемых в текущем и последующих поколениях. [53]
В животных
Трудно отследить TEI у животных из-за перепрограммирования генов во время мейоза и эмбриогенеза, особенно в диких популяциях, которые не выращиваются в лабораторных условиях. Необходимо провести дополнительные исследования для усиления документирования TEI у животных. Тем не менее, несколько примеров все же существуют. [ необходима цитата ]
Индуцированное трансгенерационное эпигенетическое наследование было продемонстрировано у животных, таких как Daphnia cucullata . Эти крошечные ракообразные будут развивать защитные шлемы в ювенильном возрасте, если подвергнутся воздействию кайромонов , типа гормона, выделяемого хищниками, пока они находятся в утробе матери. Шлем действует как метод защиты, уменьшая способность хищников захватывать дафнию , таким образом, индукция наличия шлема снизит уровень смертности. D. cucullata будет развивать небольшой шлем, если кайромоны отсутствуют. Однако, в зависимости от уровня кайромонов хищника, длина шлема почти удвоится. Следующее поколение дафний будет демонстрировать аналогичный размер шлема. Если уровни кайромонов уменьшатся или исчезнут, то третье поколение вернется к исходному размеру шлема. Эти организмы демонстрируют адаптивные фенотипы, которые повлияют на фенотип в последующих поколениях. [54]
Генетический анализ коралловых рифовых рыб Acanthochromis polyacanthus предложил TEI в ответ на изменение климата. По мере изменения климата температура воды в океане повышается. Когда A. polyacanthus подвергается воздействию более высоких температур воды до +3 °C от нормальной температуры океана, у рыб наблюдается повышенный уровень метилирования ДНК в 193 генах, что приводит к фенотипическим изменениям в функции потребления кислорода, метаболизма, инсулиновой реакции, выработки энергии и ангиогенеза. Увеличение метилирования ДНК и его фенотипические эффекты были перенесены на несколько последующих поколений. [55]
Возможный TEI изучался на морских свинках ( Cavia aperea ), подвергая самцов воздействию повышенной температуры окружающей среды в течение двух месяцев. В лаборатории самцам разрешалось спариваться с одной и той же самкой до и после воздействия тепла, чтобы определить, повлияли ли высокие температуры на потомство. Поскольку печень служит органом терморегуляции, образцы печени были изучены у отцов морских свинок (поколение F0) и печени и яичек самцов-потомков (поколение F1). Самцы F0 испытали немедленный эпигенетический ответ на повышение температуры; уровни гормонов в печени, ответственных за терморегуляцию, увеличились. Поколение F1 также показало другой метилированный эпигенетический ответ в своей печени и яичках, что указывает на то, что они потенциально могут передать эпигенетические метки поколению F2. [56]
У людей
Хотя генетическое наследование важно при описании фенотипических результатов, оно не может полностью объяснить, почему потомки похожи на своих родителей. Помимо генов, потомки наследуют схожие условия окружающей среды, установленные предыдущими поколениями. Одной из сред, которую человеческие потомки обычно разделяют со своими материнскими родителями в течение девяти месяцев, является матка . Учитывая продолжительность стадий развития плода , среда материнской матки может иметь долгосрочные последствия для здоровья потомства. [ необходима цитата ]
Примером того, как окружающая среда в утробе матери может влиять на здоровье потомства, является голландская голодная зима 1944–45 годов и ее причинное воздействие на индуцированные трансгенерационные эпигенетические наследственные заболевания. Во время голландской голодной зимы потомство, подвергшееся воздействию условий голода в третьем триместре развития, было меньше, чем те, кто родился за год до голода. Более того, было обнаружено, что потомство, рожденное во время голода, и их последующее потомство имеют повышенный риск метаболических заболеваний , сердечно-сосудистых заболеваний , непереносимости глюкозы , диабета и ожирения во взрослом возрасте. Влияние этого голода на развитие длилось до двух поколений. [9] [57] Повышенные факторы риска для здоровья поколений F1 и F2 во время голландской голодной зимы — это известный феномен, называемый « фетальным программированием », который вызван воздействием вредных факторов окружающей среды в утробе матери. [57]
Потеря генетической экспрессии, которая приводит к синдрому Прадера-Вилли или синдрому Ангельмана, в некоторых случаях была вызвана эпигенетическими изменениями (или «эпимутациями») на обоих аллелях , а не вовлечением какой-либо генетической мутации . Во всех 19 информативных случаях эпимутации, которые вместе с физиологическим импринтингом и, следовательно, подавлением другого аллеля , вызывали эти синдромы, были локализованы на хромосоме с определенным родительским и бабушкино-родительским происхождением. В частности, отцовская хромосома несла аномальную материнскую метку в SNURF-SNRPN , и эта аномальная метка была унаследована от бабушки по отцовской линии. [58]
Было обнаружено, что несколько видов рака подвержены влиянию трансгенерационной эпигенетики. Эпимутации гена MLH1 были обнаружены у двух людей с фенотипом наследственного неполипозного колоректального рака и без какой-либо явной мутации MLH1, которая в противном случае вызывала бы это заболевание. Те же эпимутации были обнаружены и в сперматозоидах одного из людей, что указывает на потенциальную возможность передачи потомству. [58] В дополнение к эпимутациям гена MLH1 было установлено, что некоторые виды рака, такие как рак молочной железы , могут возникать на фетальных стадиях внутри матки . [59] Кроме того, доказательства, собранные в различных исследованиях с использованием модельных систем (т. е. животных), показали, что воздействие в родительских поколениях может привести к многопоколенческому и трансгенерационному наследованию рака молочной железы. [59] Совсем недавно исследования обнаружили связь между адаптацией мужских зародышевых клеток посредством отцовской диеты до зачатия и регуляцией рака молочной железы у развивающегося потомства. [59] Более конкретно, исследования начали раскрывать новые данные, которые подчеркивают связь между трансгенерационным эпигенетическим наследованием рака молочной железы и предковыми пищевыми компонентами или связанными маркерами , такими как вес при рождении. [59] Используя модельные системы, такие как мыши, исследования показали, что стимулированное отцовское ожирение во время зачатия может эпигенетически изменить отцовскую зародышевую линию. Отцовская зародышевая линия отвечает за регулирование веса их дочерей при рождении и потенциальную возможность развития рака молочной железы у их дочерей. [60] Кроме того, было обнаружено, что изменения в профиле экспрессии miRNA мужской зародышевой линии связаны с повышенной массой тела. [60] Кроме того, отцовское ожирение привело к увеличению процента женского потомства, у которого развиваются опухоли молочной железы , вызванные канцерогенами , что вызвано изменениями в экспрессии miRNA молочной железы. [60]
Помимо заболеваний, связанных с раком и связанных с эффектами трансгенерационного эпигенетического наследования, трансгенерационное эпигенетическое наследование недавно было вовлечено в прогрессирование легочной артериальной гипертензии (ЛАГ). [61] Недавние исследования показали, что трансгенерационное эпигенетическое наследование, вероятно, участвует в прогрессировании ЛАГ, поскольку современные методы лечения ЛАГ не устраняют нерегулярные фенотипы, связанные с этим заболеванием. [61] Современные методы лечения ЛАГ пытались исправить симптомы ЛАГ с помощью вазодилататоров и антитромботических защитных средств , но ни один из них не смог эффективно облегчить осложнения, связанные с нарушенными фенотипами, связанными с ЛАГ. [61] Неспособность вазодилататоров и антитромботических защитных средств исправить ЛАГ предполагает, что прогрессирование ЛАГ зависит от множества переменных, что, вероятно, является следствием трансгенерационного эпигенетического наследования. [61] В частности, считается, что трансгенерационная эпигенетика связана с фенотипическими изменениями, связанными с сосудистым ремоделированием . [61] Например, гипоксия во время беременности может вызывать трансгенерационные эпигенетические изменения, которые могут оказаться пагубными на ранних стадиях развития плода и увеличить вероятность развития ЛАГ во взрослом возрасте. [61] Хотя гипоксические состояния могут вызывать трансгенерационную эпигенетическую дисперсию, связанную с ЛАГ, существуют веские доказательства, подтверждающие, что различные материнские факторы риска связаны с возможным прогрессированием ЛАГ. [61] Такие материнские факторы риска, связанные с поздним началом ЛАГ, включают плацентарную дисфункцию, гипертонию, ожирение и преэклампсию. [61] Эти материнские факторы риска и стрессоры окружающей среды в сочетании с трансгенерационными эпигенетическими изменениями могут привести к длительному повреждению сигнальных путей, связанных с развитием сосудов на стадиях плода, тем самым увеличивая вероятность наличия ЛАГ. [61]
Одно исследование показало, что насилие в детстве, которое определяется как «сексуальный контакт, тяжелое физическое насилие и/или тяжелое пренебрежение», приводит к эпигенетическим модификациям экспрессии рецепторов глюкокортикоидов. [62] [ необходим неосновной источник ] [63] [ необходим неосновной источник ] Экспрессия рецепторов глюкокортикоидов играет жизненно важную роль в активности гипоталамо-гипофизарно-надпочечниковой системы (ГГН). Кроме того, эксперименты на животных показали, что эпигенетические изменения могут зависеть от взаимодействия матери и ребенка после рождения. [64] [ необходим неосновной источник ] Кроме того, недавнее исследование, изучающее корреляции между материнским стрессом во время беременности и метилированием у подростков/их матерей, показало, что дети женщин, подвергшихся насилию во время беременности, с большей вероятностью имели метилированные гены рецепторов глюкокортикоидов. [65] [ необходим неосновной источник ] Таким образом, дети с метилированными генами рецепторов глюкокортикоидов испытывают измененную реакцию на стресс, что в конечном итоге приводит к более высокой восприимчивости к переживанию тревожности. [65] [ необходим неосновной источник ]
Дополнительные исследования, изучающие эффекты диэтилстильбестрола (DES), который является эндокринным разрушителем , обнаружили, что внуки (третье поколение) женщин, подвергшихся воздействию DES, значительно увеличили вероятность развития у своих внуков синдрома дефицита внимания и гиперактивности (СДВГ). [66] Это связано с тем, что женщины, подвергшиеся воздействию эндокринных разрушителей , таких как DES, во время беременности , могут быть связаны с многопоколенными нарушениями нейроразвития . [66] Кроме того, исследования на животных показывают, что эндокринные разрушители оказывают глубокое влияние на клетки зародышевой линии и нейроразвитие. [66] Предполагается, что причиной многопоколенного воздействия DES является результат биологических процессов, связанных с эпигенетическим перепрограммированием зародышевой линии , хотя это еще предстоит определить. [66]
Влияние на физическую форму
Эпигенетическое наследование может влиять на приспособленность только в том случае, если оно предсказуемо изменяет признак при отборе. Были получены доказательства того, что стимулы окружающей среды являются важными агентами в изменении эпигенов. По иронии судьбы, дарвиновская эволюция может воздействовать на эти неоламарковские приобретенные характеристики, а также на клеточные механизмы, их производящие (например, гены метилтрансферазы). Эпигенетическое наследование может давать преимущество приспособленности организмам, которые имеют дело с изменениями окружающей среды в промежуточных временных масштабах. [67] Изменения с коротким циклом, вероятно, будут иметь регуляторные процессы, кодируемые ДНК, поскольку вероятность того, что потомству придется реагировать на изменения несколько раз в течение своей жизни, высока. С другой стороны, естественный отбор будет воздействовать на популяции, испытывающие изменения при изменениях окружающей среды с более длинным циклом. В этих случаях, если эпигенетическое праймирование следующего поколения пагубно для приспособленности в течение большей части интервала (например, дезинформация об окружающей среде), эти генотипы и эпигенотипы будут потеряны. Для промежуточных временных циклов вероятность того, что потомство столкнется с похожей средой, достаточно высока без существенного селективного давления на особей, не имеющих генетической архитектуры, способной реагировать на среду. Естественно, абсолютная длина коротких, промежуточных и длинных экологических циклов будет зависеть от признака, длины эпигенетической памяти и времени генерации организма. Большая часть интерпретации эффектов эпигенетической приспособленности сосредоточена на гипотезе о том, что эпигены вносят важный вклад в фенотипы, что еще предстоит решить. [ необходима цитата ]
Вредные эффекты
Унаследованные эпигенетические метки могут быть важны для регулирования важных компонентов приспособленности. Например, у растений ген Lcyc в Linaria vulgaris контролирует симметрию цветка. Линней впервые описал радиально-симметричные мутанты, которые возникают, когда Lcyc сильно метилирован. [68] Учитывая важность формы цветка для опылителей, [69] метилирование гомологов Lcyc (например, CYCLOIDEA ) может иметь пагубные последствия для приспособленности растений. У животных многочисленные исследования показали, что унаследованные эпигенетические метки могут повышать восприимчивость к болезням. Предполагается, что трансгенерационные эпигенетические влияния также способствуют возникновению болезней, особенно рака, у людей. [70] Было показано, что паттерны метилирования опухолей в промоторах генов положительно коррелируют с семейной историей рака. [71] Кроме того, метилирование гена MSH2 коррелирует с ранним началом колоректального и эндометриального рака. [72]
Предположительно адаптивные эффекты
Экспериментально деметилированные семена модельного организма Arabidopsis thaliana имеют значительно более высокую смертность, замедленный рост, задержку цветения и более низкое завязывание плодов, [73] что указывает на то, что эпигены могут повышать приспособленность. Кроме того, было показано, что эпигенетические реакции на стресс, вызванные окружающей средой, наследуются и положительно коррелируют с приспособленностью. [74] У животных совместное гнездование изменяет поведение мышей, усиливая режимы родительской заботы [75] и социальные способности [76] , которые, как предполагается, повышают выживаемость потомства и доступ к ресурсам (таким как еда и партнеры) соответственно. [ необходима цитата ]
Наследование иммунитета
Эпигенетика играет решающую роль в регуляции и развитии иммунной системы. [77] В 2021 году были представлены доказательства наследования тренированного иммунитета через поколения к потомству мышей с системной инфекцией Candida albicans . [78] Потомство мышей пережило инфекцию Candida albicans благодаря функциональным, транскрипционным и эпигенетическим изменениям, связанным с локусами иммунных генов. [78] Реагирование миелоидных клеток на инфекцию Candida albicans увеличилось в воспалительных путях, и устойчивость к инфекциям увеличилась в следующих поколениях. [78] Иммунитет у позвоночных также может передаваться от матери через передачу гормонов, питательных веществ и антител. [79] У млекопитающих материнские факторы могут передаваться через лактацию или плаценту. [79] Трансгенерационная передача признаков, связанных с иммунитетом, также описана у растений и беспозвоночных. Растения имеют систему прайминга защиты, которая позволяет им иметь альтернативный защитный ответ, который может быть ускорен при воздействии стрессовых воздействий или патогенов. [80] После события прайминга информация о стрессе прайминга сохраняется, и память может быть унаследована у потомства (межпоколенческим или трансгенерационным). [80] В исследованиях потомство Arabidopsis, инфицированное Pseudomonas syringae, было праймировано во время выражения системной приобретенной устойчивости (SAR). [81] Потомство показало наличие устойчивости к (геми)-биотрофным патогенам, которая связана с генами, зависимыми от салициловой кислоты, и геном, регулирующим защиту, не экспрессирующим гены PR (NPR1). [81] Трансгенерационный SAR у потомства был связан с повышенным ацетилированием гистона 3 по лизину 9, гипометилированием генов и хроматиновыми метками на промоторных участках генов, зависимых от салициловой кислоты. [81] Аналогично у насекомых красный мучной хрущак Tribolium castaneum подвергается воздействию патогена Bacillus thuringiensis . [79] Эксперименты по двойному спариванию с красным мучным хрущаком продемонстрировали, что отцовское трансгенерационное иммунное примирование опосредуется спермой или семенной жидкостью, что повышает выживаемость при воздействии патогенов и способствует эпигенетическим изменениям. [79]
Контуры обратной связи и TEI
Положительные и отрицательные петли обратной связи обычно наблюдаются в молекулярных механизмах и регуляции гомеостатических процессов. Имеются доказательства того, что петли обратной связи взаимодействуют для поддержания эпигенетических модификаций в пределах одного поколения, а также способствуют TEI у различных организмов, и эти петли обратной связи могут демонстрировать предполагаемые адаптации к возмущениям окружающей среды. Петли обратной связи действительно являются следствием любой эпигенетической модификации, поскольку они приводят к изменениям в экспрессии. Более того, петли обратной связи, наблюдаемые в нескольких поколениях из-за TEI, демонстрируют пространственно-временную динамику, которая связана только с TEI. Например, повышенные температуры во время эмбриогенеза и установление PIWI RNA (piRNA) прямо пропорциональны, обеспечивая наследуемый результат для подавления мобильных элементов через кластеры piRNA. [82] Более того, последующие поколения сохраняют активный локус для продолжения установления piRNA, чье формирование ранее было загадочным. [82] В другом случае было высказано предположение, что эндокринные нарушения имели взаимодействие петли обратной связи с метилированием различных геномных участков в Menidia beryllina , что могло быть функцией TEI. [83] Когда воздействие было прекращено, потомство M. beryllina F2 все еще сохраняло эти метки метилирования, что вызывало отрицательную обратную связь при экспрессии различных генов. [83] В другом примере гибридизация угрей может привести к петлям обратной связи, способствующим деметилированию транспозона и активации транспозируемых элементов. [84] Поскольку TE обычно подавляются в геноме, их присутствие и потенциальная экспрессия создают петлю обратной связи, чтобы предотвратить размножение гибридов с другими гибридами или негибридными видами, что устраняет пролиферацию экспрессии TE и предотвращает TEI в этом контексте. Это явление известно как форма постзиготической репродуктивной изоляции.
Макроэволюционные модели
Унаследованные эпигенетические эффекты на фенотипы были хорошо документированы у бактерий, простейших, грибов, растений, нематод и плодовых мушек. [85] [19] Хотя систематическое исследование эпигенетического наследования не проводилось (большинство из них сосредоточено на модельных организмах), есть предварительные доказательства того, что этот способ наследования более важен у растений, чем у животных. [85] Ранняя дифференциация зародышевых линий животных , вероятно, исключает эпигенетическую маркировку, происходящую на более поздних этапах развития, в то время как у растений и грибов соматические клетки могут быть включены в зародышевую линию. [86] [87]
Считается, что трансгенерационное эпигенетическое наследование может позволить определенным популяциям легко адаптироваться к изменчивым условиям. [19] Хотя существуют хорошо документированные случаи трансгенерационного эпигенетического наследования в определенных популяциях, существуют вопросы относительно того, применима ли эта же форма адаптивности к млекопитающим. [19] Более конкретно, ставится под сомнение, применима ли она к людям. [19] В последнее время большинство экспериментальных моделей, использующих мышей, и ограниченные наблюдения за людьми обнаружили только эпигенетически унаследованные черты, которые пагубны для здоровья обоих организмов. [19] Эти вредные черты варьируются от повышенного риска заболеваний, таких как сердечно-сосудистые заболевания , до преждевременной смерти. [19] Однако это может быть основано на предпосылке ограниченной предвзятости отчетности, поскольку легче обнаружить отрицательные экспериментальные эффекты, в отличие от положительных экспериментальных эффектов. [19] Более того, значительное эпигенетическое перепрограммирование, необходимое для эволюционного успеха зародышевых линий и начальных фаз эмбриогенеза у млекопитающих, может быть потенциальной причиной, ограничивающей трансгенерационное наследование хроматиновых меток у млекопитающих. [19]
Модели жизненного цикла также могут способствовать возникновению эпигенетического наследования. Сидячие организмы, те, у которых низкая способность к расселению, и те, у которых простое поведение, могут извлечь наибольшую пользу из передачи информации своему потомству через эпигенетические пути. Географические модели также могут возникнуть, когда высоко изменчивые и высококонсервативные среды могут содержать меньше видов с важным эпигенетическим наследованием. [ необходима цитата ]
Споры
Люди давно осознали, что черты родителей часто проявляются у потомков. Это понимание привело к практическому применению селективного разведения растений и животных, но не затронуло центральный вопрос наследования: как эти черты сохраняются между поколениями и что вызывает изменчивость? В истории эволюционной мысли было несколько позиций. [ необходима цитата ]
Смешивание против частичного наследования
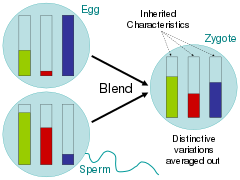
Обращаясь к этим связанным вопросам, ученые эпохи Просвещения в основном отстаивали гипотезу смешивания, в которой родительские черты гомогенизировались в потомстве, подобно тому, как смешиваются ведра с разноцветной краской. [88] Критики книги Чарльза Дарвина «О происхождении видов» указывали, что при такой схеме наследования вариации быстро подавляются фенотипом большинства. [89] В аналогии с ведром краски это можно было бы увидеть, смешав два цвета вместе, а затем смешав полученный цвет только с одним из родительских цветов 20 раз; редкий вариант цвета быстро бы исчез. [ необходима цитата ]
Неизвестный большинству европейского научного сообщества, монах Грегор Мендель решил вопрос о том, как признаки сохраняются между поколениями с помощью экспериментов по селекции с растениями гороха. [90] Таким образом, Чарльз Дарвин не знал о предложенном Менделем «частичном наследовании», в котором признаки не смешивались, а передавались потомству в дискретных единицах, которые мы теперь называем генами. Дарвин пришел к отказу от гипотезы смешивания, хотя его идеи и идеи Менделя не были объединены до 1930-х годов, периода, называемого современным синтезом . [ необходима цитата ]
Наследование врожденных и приобретенных признаков
В своей книге 1809 года «Зоологическая философия» [ 91] Жан-Батист Ламарк признал, что каждый вид сталкивается с уникальным набором проблем, обусловленных его формой и средой обитания. Таким образом, он предположил, что наиболее часто используемые признаки будут накапливать «нервную жидкость». Такие приобретенные накопления затем будут передаваться потомству особи. Говоря современным языком, нервная жидкость, переданная потомству, будет формой эпигенетического наследования. [ необходима цитата ]
Ламаркизм , как стало известно это течение мысли, был стандартным объяснением изменения видов с течением времени, когда Чарльз Дарвин и Альфред Рассел Уоллес совместно предложили теорию эволюции путем естественного отбора в 1859 году. В ответ на теорию Дарвина и Уоллеса пересмотренный неоламаркизм привлек небольшое число последователей-биологов, [92] хотя ламаркистский пыл был угас в значительной степени из-за знаменитого эксперимента Вейсмана [93] , в котором он отрезал хвосты мышам в течение нескольких последовательных поколений, не оказав никакого влияния на длину хвоста. Таким образом, возникший консенсус о том, что приобретенные характеристики не могут быть унаследованы, стал каноном. [24]
Пересмотр эволюционной теории
Однако негенетические вариации и наследование оказались довольно распространенными. Одновременно с развитием в 20 веке современного эволюционного синтеза (объединяющего менделевскую генетику и естественный отбор), CH Waddington (1905–1975) работал над объединением биологии развития и генетики. При этом он принял слово «эпигенетический» [94] для обозначения упорядоченной дифференциации эмбриональных клеток в функционально различные типы клеток, несмотря на идентичную первичную структуру их ДНК. [95] Исследователи спорадически обсуждали эпигенетику Waddington - она стала скорее всеобъемлющим понятием для загадочных негенетических наследуемых признаков, а не концепцией, продвигающей корпус исследования. [96] [97] Следовательно, определение слова Waddington само по себе эволюционировало, расширившись за пределы подмножества сигнализируемой развитием, унаследованной специализации клеток.
Некоторые ученые задаются вопросом, не ставит ли эпигенетическое наследование под угрозу основу современного синтеза. Описывая центральную догму молекулярной биологии , Фрэнсис Крик [98] лаконично заявил: «ДНК удерживается в конфигурации гистонами[ами], так что она может действовать как пассивный шаблон для одновременного синтеза РНК и белка[ов]. Никакой подробной «информации» нет в гистоне». Однако он завершает статью, заявляя: «Эта схема объясняет большинство настоящих экспериментальных результатов!» Действительно, появление эпигенетического наследования (в дополнение к достижениям в изучении эволюционного развития, фенотипической пластичности , эволюционируемости и системной биологии) напрягло нынешнюю структуру современного эволюционного синтеза и побудило пересмотреть ранее отвергнутые эволюционные механизмы. [99]
Более того, закономерности эпигенетического наследования и эволюционные последствия эпигенетических кодов в живых организмах связаны как с теориями эволюции Ламарка , так и Дарвина . [100] Например, Ламарк постулировал, что факторы окружающей среды ответственны за изменение фенотипов по наследству , что подтверждает конструкции о том, что воздействие факторов окружающей среды на критических стадиях развития может привести к эпимутациям в зародышевых линиях , тем самым увеличивая фенотипическую дисперсию. [100] Напротив, теория Дарвина утверждала, что естественный отбор усилил способность популяции выживать и оставаться репродуктивно приспособленной, благоприятствуя популяциям, которые способны легко адаптироваться. [100] Эта теория согласуется с межпоколенческой пластичностью и фенотипической дисперсией, возникающей в результате наследственной адаптивности. [100]
Кроме того, некоторая эпигенетическая изменчивость может обеспечить полезную пластичность , так что некоторые организмы могут адаптироваться к изменяющимся условиям окружающей среды. Однако обмен эпигенетической информацией между поколениями может привести к эпигенетическим аберрациям, которые являются эпигенетическими признаками, отклоняющимися от нормы. Таким образом, потомство родительских поколений может быть предрасположено к определенным заболеваниям и снижению пластичности из-за эпигенетических аберраций. Хотя способность легко адаптироваться при столкновении с новой средой может быть полезна для определенных популяций видов, которые могут быстро размножаться, виды с большим разрывом поколений могут не извлечь выгоду из такой способности. Если вид с большим разрывом поколений не адаптируется должным образом к ожидаемой среде, то репродуктивная приспособленность потомства этого вида будет снижена. [ необходима цитата ]
Было проведено критическое обсуждение основной эволюционной теории Эдвардом Дж. Стилом , Робин А. Линдли и коллегами, [101] [102] [103] [104] [105] Фредом Хойлом и Н. Чандрой Викрамасингхе , [106] [107] [108] Юншэном Лю [109] [110] Денисом Ноблом , [111] [112] Джоном Мэттиком [113] и другими, которые пришли к выводу, что логические несоответствия, а также эффекты ламаркистского наследования, включающие прямые модификации ДНК, а также только что описанные косвенные, а именно эпигенетические, передачи бросают вызов традиционному мышлению в эволюционной биологии и смежных областях. [ необходима ссылка ]
Смотрите также
- Вклад эпигенетических модификаций в эволюцию
- Голландский голод 1944–45 гг.#Наследие
- Эпигенетика тревожных и стрессовых расстройств
- Исследование Оверкаликса
- Трансгенерационное эпигенетическое наследование у растений
- Трансгенерационное наследование стресса
- Трансгенерационная травма
- Индуцируемая защита растений от травоядных
Ссылки
- ^ ab Мур, Дэвид Скотт (2015). Развивающийся геном: введение в поведенческую эпигенетику. Оксфорд. ISBN 978-0-19-992235-2. OCLC 899240120.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Пикаард, Крейг С.; Миттельстен Шайд, Ортрун (декабрь 2014 г.). «Эпигенетическая регуляция у растений». Cold Spring Harbor Perspectives in Biology . 6 (12): a019315. doi :10.1101/cshperspect.a019315. ISSN 1943-0264. PMC 4292151. PMID 25452385 .
- ^ abc Херд, Эдит; Мартиенссен, Роберт А. (2014-03-27). «Трансгенерационное эпигенетическое наследование: мифы и механизмы». Cell . 157 (1): 95– 109. doi :10.1016/j.cell.2014.02.045. ISSN 0092-8674. PMC 4020004 . PMID 24679529.
- ^ abc Фиц-Джеймс, Максимилиан Х.; Кавалли, Джакомо (июнь 2022 г.). «Молекулярные механизмы трансгенерационного эпигенетического наследования». Nature Reviews Genetics . 23 (6): 325– 341. doi :10.1038/s41576-021-00438-5. ISSN 1471-0064. PMID 34983971. S2CID 245703043.
- ^ Фиц-Джеймс, Максимилиан Х.; Кавалли, Джакомо (июнь 2022 г.). «Молекулярные механизмы трансгенерационного эпигенетического наследования». Nature Reviews Genetics . 23 (6): 325– 341. doi :10.1038/s41576-021-00438-5. ISSN 1471-0056. PMID 34983971. S2CID 245703043.
- ^ Икбал, Куршед; Джин, Сын-Ги; Пфайфер, Герд П.; Сабо, Пироска Э. (март 2011 г.). «Перепрограммирование отцовского генома при оплодотворении включает в себя окисление 5-метилцитозина по всему геному». Труды Национальной академии наук . 108 (9): 3642– 3647. Bibcode : 2011PNAS..108.3642I. doi : 10.1073/pnas.1014033108 . ISSN 0027-8424. PMC 3048122. PMID 21321204 .
- ^ Хасби, Арильд (2022-02-09). «Дикая эпигенетика: выводы из эпигенетических исследований природных популяций». Труды Королевского общества B: Биологические науки . 289 (1968): 20211633. doi :10.1098/rspb.2021.1633. ISSN 0962-8452. PMC 8826306. PMID 35135348 .
- ^ ab Ho, Shuk-Mei; Johnson, Abby; Tarapore, Pheruza; Janakiram, Vinothini; Zhang, Xiang; Leung, Yuet-Kin (декабрь 2012 г.). «Экологическая эпигенетика и ее влияние на риск заболеваний и результаты для здоровья». Журнал ILAR . 53 ( 3– 4): 289– 305. doi : 10.1093/ilar.53.3-4.289. ISSN 1084-2020. PMC 4021822. PMID 23744968 .
- ^ ab Эммануэль, ДРУЭ (2016-09-30). "Эпигенетика: как окружающая среда влияет на наши гены". Энциклопедия окружающей среды . Получено 2023-02-22 .
- ^ ab Jablonka, Eva; Raz, Gal (июнь 2009 г.). «Трансгенерационное эпигенетическое наследование: распространенность, механизмы и последствия для изучения наследственности и эволюции». The Quarterly Review of Biology . 84 (2): 131– 176. doi :10.1086/598822. ISSN 0033-5770. PMID 19606595. S2CID 7233550.
- ^ ab Ли, Донг; Ян, Янь; Ли, Юпин; Чжу, Сяохуа; Ли, Цзэцинь (2021-07-01). «Эпигенетическая регуляция экспрессии генов в ответ на воздействие окружающей среды: от стенда к модели». Science of the Total Environment . 776 : 145998. Bibcode : 2021ScTEn.77645998L. doi : 10.1016/j.scitotenv.2021.145998. ISSN 0048-9697. S2CID 233548366.
- ^ «Упаковка ДНК: нуклеосомы и хроматин | Изучайте науку на Scitable». www.nature.com . Получено 26.02.2023 .
- ^ Ван, Цинь-Ли; Мэн, Сяо; Ван, Чунъян; Дай, Вэньюй; Ло, Чжэньхуань; Инь, Чжинань; Цзюй, Чжэньюй; Фу, Сяоди; Ян, Цзин; Да, Цюньшань; Чжан, Чжан-Хуэй; Чжоу, Цинхуа (9 февраля 2022 г.). «Модификация гистона H3K4me3 является трансгенерационным эпигенетическим сигналом для метаболизма липидов у Caenorhabditis elegans». Природные коммуникации . 13 (1): 768. Бибкод : 2022NatCo..13..768W. дои : 10.1038/s41467-022-28469-4. ISSN 2041-1723. ПМЦ 8828817 . PMID 35140229.
- ^ ab Seong, Ki-Hyeon; Li, Dong; Shimizu, Hideyuki; Nakamura, Ryoichi; Ishii, Shunsuke (2011-06-24). "Наследование вызванных стрессом эпигенетических изменений, зависящих от ATF-2". Cell . 145 (7): 1049– 1061. doi : 10.1016/j.cell.2011.05.029 . ISSN 0092-8674. PMID 21703449. S2CID 2918891.
- ^ Сен, Рвик; Барнс, Кристофер (июнь 2021 г.). «Имеют ли трансгенерационное эпигенетическое наследование и развитие иммунной системы общие эпигенетические процессы?». Журнал биологии развития . 9 (2): 20. doi : 10.3390/jdb9020020 . ISSN 2221-3759. PMC 8162332. PMID 34065783 .
- ^ abcd Gapp, Katharina; Jawaid, Ali; Sarkies, Peter; Bohacek, Johannes; Pelczar, Pawel; Prados, Julien; Farinelli, Laurent; Miska, Eric; Mansuy, Isabelle M. (май 2014 г.). «Влияние сперматозоидных РНК на трансгенерационное наследование эффектов ранней травмы у мышей». Nature Neuroscience . 17 (5): 667– 669. doi :10.1038/nn.3695. ISSN 1546-1726. PMC 4333222 . PMID 24728267.
- ^ Роджерс, Али Б.; Морган, Кристофер П.; Лей, Н. Адриан; Бэйл, Трейси Л. (2015-11-03). «Трансгенерационное эпигенетическое программирование с помощью микроРНК спермы повторяет эффекты отцовского стресса». Труды Национальной академии наук . 112 (44): 13699– 13704. Bibcode : 2015PNAS..11213699R. doi : 10.1073/pnas.1508347112 . ISSN 0027-8424. PMC 4640733. PMID 26483456 .
- ^ ab Rechavi, Oded; Houri-Ze'evi, Leah; Anava, Sarit; Goh, Wee Siong Sho; Kerk, Sze Yen; Hannon, Gregory J.; Hobert, Oliver (2014-07-17). "Трансгенерационное наследование малых РНК, вызванное голоданием, у C. elegans". Cell . 158 (2): 277– 287. doi :10.1016/j.cell.2014.06.020. ISSN 0092-8674. PMC 4377509 . PMID 25018105.
- ^ abcdefghi Horsthemke B (июль 2018 г.). «Критический взгляд на трансгенерационное эпигенетическое наследование у людей». Nature Communications . 9 (1): 2973. Bibcode :2018NatCo...9.2973H. doi :10.1038/s41467-018-05445-5. PMC 6065375 . PMID 30061690.
- ^ Duclos KK, Hendrikse JL, Jamniczky HA (сентябрь 2019 г.). «Исследование эволюции и развития биологической сложности в рамках эпигенетики». Эволюция и развитие . 21 (5): 247– 264. doi :10.1111/ede.12301. PMC 6852014. PMID 31268245 .
- ^ ab Bond DM, Finnegan EJ (май 2007 г.). «Передача сообщения: наследование эпигенетических признаков». Trends in Plant Science . 12 (5): 211– 216. Bibcode : 2007TPS....12..211B. doi : 10.1016/j.tplants.2007.03.010. PMID 17434332.
- ^ Morison IM, Reeve AE (1998). «Каталог импринтированных генов и эффектов родительского происхождения у людей и животных». Human Molecular Genetics . 7 (10): 1599–1609 . doi : 10.1093/hmg/7.10.1599 . PMID 9735381.
- ^ Скотт Р. Дж., Шпильман М., Бейли Дж., Дикинсон Х. Г. (сентябрь 1998 г.). «Влияние происхождения родителей на развитие семян Arabidopsis thaliana». Development . 125 (17): 3329– 3341. doi :10.1242/dev.125.17.3329. PMID 9693137.
- ^ ab Moore DS (2015). Развивающийся геном . Oxford University Press. ISBN 978-0-19-992234-5.[ необходимо страниц ]
- ^ Adenot PG, Mercier Y, Renard JP, Thompson EM (ноябрь 1997 г.). «Дифференциальное ацетилирование H4 отцовского и материнского хроматина предшествует репликации ДНК и дифференциальной транскрипционной активности в пронуклеусах одноклеточных эмбрионов мыши». Development . 124 (22): 4615– 4625. doi :10.1242/dev.124.22.4615. PMID 9409678.
- ^ Сантос Ф., Хендрих Б., Рейк В., Дин В. (январь 2002 г.). «Динамическое перепрограммирование метилирования ДНК в раннем эмбрионе мыши». Developmental Biology . 241 (1): 172–182 . doi : 10.1006/dbio.2001.0501 . PMID 11784103.
- ^ Oswald J, Engemann S, Lane N, Mayer W, Olek A, Fundele R и др. (апрель 2000 г.). «Активное деметилирование отцовского генома в зиготе мыши». Current Biology . 10 (8): 475– 478. Bibcode : 2000CBio...10..475O. doi : 10.1016/S0960-9822(00)00448-6 . PMID 10801417.
- ^ Fulka H, Mrazek M, Tepla O, Fulka J (декабрь 2004 г.). «Паттерн метилирования ДНК в зиготах человека и развивающихся эмбрионах». Reproduction . 128 (6): 703–708 . doi :10.1530/rep.1.00217. PMID 15579587. S2CID 28719804.
- ^ Hackett JA, Sengupta R, Zylicz JJ, Murakami K, Lee C, Down TA, Surani MA (январь 2013 г.). «Динамика деметилирования ДНК зародышевой линии и стирание импринта посредством 5-гидроксиметилцитозина». Science . 339 (6118): 448– 452. Bibcode :2013Sci...339..448H. doi :10.1126/science.1229277. PMC 3847602 . PMID 23223451.
- ^ Surani MA, Hajkova P (2010). «Эпигенетическое перепрограммирование зародышевых клеток мыши в сторону тотипотентности». Симпозиумы Cold Spring Harbor по количественной биологии . 75 : 211–218 . doi : 10.1101/sqb.2010.75.010 . PMID 21139069.
- ^ Чжан Z, Шибахара K, Стиллман B (ноябрь 2000 г.). «PCNA связывает репликацию ДНК с эпигенетическим наследованием у дрожжей». Nature . 408 (6809): 221– 225. Bibcode :2000Natur.408..221Z. doi :10.1038/35041601. PMID 11089978. S2CID 205010657.
- ^ Henderson DS, Banga SS, Grigliatti TA, Boyd JB (март 1994). «Чувствительность к мутагенам и подавление позиционно-эффектной мозаичности являются результатом мутаций в mus209, гене Drosophila, кодирующем PCNA». The EMBO Journal . 13 (6): 1450– 1459. doi :10.1002/j.1460-2075.1994.tb06399.x. PMC 394963. PMID 7907981.
- ^ Probst AV, Dunleavy E, Almouzni G (март 2009). «Эпигенетическое наследование во время клеточного цикла». Nature Reviews. Molecular Cell Biology . 10 (3): 192– 206. doi :10.1038/nrm2640. PMID 19234478. S2CID 205494340.
- ^ ab Morgan HD, Santos F, Green K, Dean W, Reik W (апрель 2005 г.). «Эпигенетическое перепрограммирование у млекопитающих». Human Molecular Genetics . 14 (Обзор выпуска 1): R47 – R58 . doi : 10.1093/hmg/ddi114 . PMID 15809273.
- ^ Santos F, Peters AH, Otte AP, Reik W, Dean W (апрель 2005 г.). «Динамические модификации хроматина характеризуют первый клеточный цикл у эмбрионов мышей». Developmental Biology . 280 (1): 225–236 . doi :10.1016/j.ydbio.2005.01.025. PMID 15766761.
- ^ Taguchi YH (2015). «Идентификация аберрантной экспрессии генов, связанной с аберрантным метилированием промотора в первичных зародышевых клетках между поколениями крысы E13 и E16 F3 винклозолиновой линии». BMC Bioinformatics . 16 (Suppl 18): S16. doi : 10.1186/1471-2105-16-S18-S16 . PMC 4682393 . PMID 26677731.
- ^ Ричардс Э.Дж. (май 2006 г.). «Наследуемая эпигенетическая изменчивость — пересмотр мягкого наследования». Nature Reviews. Genetics . 7 (5): 395– 401. doi :10.1038/nrg1834. PMID 16534512. S2CID 21961242.
- ^ Дэй, Джереми Дж. (2014-09-30). «Новые подходы к манипулированию эпигеномом». Диалоги по клинической нейронауке . 16 (3): 345–357 . doi :10.31887/DCNS.2014.16.3/jday. ISSN 1958-5969. PMC 4214177. PMID 25364285 .
- ^ abcd Coe EH (июнь 1959). «Регулярное и продолжающееся явление типа конверсии в локусе B у кукурузы». Труды Национальной академии наук Соединенных Штатов Америки . 45 (6): 828– 832. Bibcode :1959PNAS...45..828C. doi : 10.1073/pnas.45.6.828 . PMC 222644 . PMID 16590451.
- ^ Chandler VL (февраль 2007). «Парамутация: от кукурузы до мышей». Cell . 128 (4): 641– 645. doi : 10.1016/j.cell.2007.02.007 . PMID 17320501.
- ^ ab Stam M, Belele C, Ramakrishna W, Dorweiler JE, Bennetzen JL, Chandler VL (октябрь 2002 г.). «Регуляторные области, необходимые для парамутации и экспрессии B', расположены далеко вверх по течению от транскрибируемых последовательностей b1 кукурузы». Genetics . 162 (2): 917– 930. doi :10.1093/genetics/162.2.917. PMC 1462281 . PMID 12399399.
- ^ ab Belele CL, Sidorenko L, Stam M, Bader R, Arteaga-Vazquez MA, Chandler VL (2013-10-17). "Специфические тандемные повторы достаточны для вызванного парамутацией трансгенерационного сайленсинга". PLOS Genetics . 9 (10): e1003773. doi : 10.1371/journal.pgen.1003773 . PMC 3798267 . PMID 24146624.
- ^ ab Arteaga-Vazquez M, Sidorenko L, Rabanal FA, Shrivistava R, Nobuta K, Green PJ, et al. (Июль 2010 г.). «РНК-опосредованная транскоммуникация может устанавливать парамутацию в локусе b1 у кукурузы». Труды Национальной академии наук Соединенных Штатов Америки . 107 (29): 12986– 12991. Bibcode : 2010PNAS..10712986A. doi : 10.1073/pnas.1007972107 . PMC 2919911. PMID 20616013 .
- ^ ab Louwers M, Bader R, Haring M, van Driel R, de Laat W, Stam M (март 2009 г.). «Специфическое для тканей и уровня экспрессии хроматиновое образование петель в эпиаллелях кукурузы b1». The Plant Cell . 21 (3): 832– 842. doi :10.1105/tpc.108.064329. PMC 2671708. PMID 19336692 .
- ^ ab Haring M, Bader R, Louwers M, Schwabe A, van Driel R, Stam M (август 2010 г.). «Роль метилирования ДНК, занятости нуклеосом и модификаций гистонов в парамутации». The Plant Journal . 63 (3): 366– 378. doi : 10.1111/j.1365-313X.2010.04245.x . PMID 20444233.
- ^ ab Dorweiler JE, Carey CC, Kubo KM, Hollick JB, Kermicle JL, Chandler VL (ноябрь 2000 г.). "медиатор парамутации1 необходим для установления и поддержания парамутации в нескольких локусах кукурузы". The Plant Cell . 12 (11): 2101– 2118. doi :10.1105/tpc.12.11.2101. PMC 150161 . PMID 11090212.
- ^ abc Chandler V, Alleman M (апрель 2008 г.). «Парамутация: эпигенетические инструкции, передаваемые из поколения в поколение». Genetics . 178 (4): 1839– 1844. doi :10.1093/genetics/178.4.1839. PMC 2323780 . PMID 18430919.
- ^ Nobuta K, Lu C, Shrivastava R, Pillay M, De Paoli E, Accerbi M и др. (сентябрь 2008 г.). «Различное распределение эндогенных siRNA в кукурузе: данные глубокого секвенирования мутанта mop1-1». Труды Национальной академии наук Соединенных Штатов Америки . 105 (39): 14958– 14963. Bibcode : 2008PNAS..10514958N. doi : 10.1073/pnas.0808066105 . PMC 2567475. PMID 18815367 .
- ^ Alleman M, Sidorenko L, McGinnis K, Seshadri V, Dorweiler JE, White J, et al. (Июль 2006). «Для парамутации в кукурузе требуется РНК-зависимая РНК-полимераза». Nature . 442 (7100): 295– 298. Bibcode :2006Natur.442..295A. doi :10.1038/nature04884. PMID 16855589. S2CID 4419412.
- ^ Arteaga-Vazquez MA, Chandler VL (апрель 2010 г.). «Парамутация в кукурузе: опосредованное РНК трансгенерационное подавление генов». Current Opinion in Genetics & Development . 20 (2): 156– 163. doi :10.1016/j.gde.2010.01.008. PMC 2859986. PMID 20153628 .
- ^ Хуан Дж., Линн Дж. С., Шульте Л., Вендрамин С., МакГиннис К. (2017-01-01). «Эпигенетический контроль экспрессии генов в кукурузе». Международный обзор клеточной и молекулярной биологии . 328 : 25–48 . doi :10.1016/bs.ircmb.2016.08.002. ISBN 9780128122204. PMID 28069135.
- ^ Chandler VL (октябрь 2010 г.). «Свойства и головоломки парамутации». Science . 330 (6004): 628– 629. Bibcode :2010Sci...330..628C. doi :10.1126/science.1191044. PMID 21030647. S2CID 13248794.
- ^ Собрал, Мар; Сампедро, Луис; Нейлан, Изабель; Сименс, Дэвид; Дирзо, Родольфо (17.08.2021). «Фенотипическая пластичность в защите растений на разных стадиях жизни: индуцируемость, трансгенерационная индукция и трансгенерационное праймирование у дикой редьки». Труды Национальной академии наук . 118 (33): e2005865118. Bibcode : 2021PNAS..11805865S. doi : 10.1073/pnas.2005865118 . ISSN 0027-8424. PMC 8379918. PMID 34389664 .
- ^ Агравал, Анураг А.; Лафорш, Кристиан; Толриан, Ральф (1999-09-02). «Трансгенерационная индукция защит у животных и растений». Nature . 401 (6748): 60– 63. Bibcode :1999Natur.401...60A. doi :10.1038/43425. ISSN 0028-0836. S2CID 4326322.
- ^ Рю, Тэу; Вейльё, Хизер Д.; Донельсон, Дженнифер М.; Мандей, Филип Л.; Раваси, Тимоти (30.04.2018). «Эпигенетический ландшафт трансгенерационной акклиматизации к потеплению океана». Nature Climate Change . 8 (6): 504–509 . Bibcode : 2018NatCC...8..504R. doi : 10.1038/s41558-018-0159-0. ISSN 1758-678X. S2CID 90082460.
- ^ Ху, Дж.; Барретт, РДХ (2017-07-20). «Эпигенетика в естественных популяциях животных». Журнал эволюционной биологии . 30 (9): 1612– 1632. doi : 10.1111/jeb.13130 . ISSN 1010-061X. PMID 28597938. S2CID 20558647.
- ^ ab Stein, A. D (2004-07-28). «Воздействие внутриутробного голода и пропорции тела при рождении: голландская голодная зима». Международный журнал эпидемиологии . 33 (4): 831– 836. doi : 10.1093/ije/dyh083 . ISSN 1464-3685. PMID 15166208.
- ^ ab Wei Y, Schatten H, Sun QY (2014). «Экологическое эпигенетическое наследование через гаметы и его значение для воспроизводства человека». Human Reproduction Update . 21 (2): 194–208 . doi : 10.1093/humupd/dmu061 . PMID 25416302.
- ^ abcd da Cruz, RS, Chen, E., Smith, M., Bates, J., & de Assis, S. (2020). Диета и трансгенерационное эпигенетическое наследование рака молочной железы: роль отцовской зародышевой линии. Frontiers in nutrition, 7, 93. https://doi.org/10.3389/fnut.2020.0009
- ^ abc Fontelles CC, Carney E, Clarke J, Nguyen NM, Yin C, Jin L, Cruz MI, Ong TP, Hilakivi-Clarke L, de Assis S (июнь 2016 г.). «Избыточный вес у отцов связан с повышенным риском рака груди у дочерей в мышиной модели». Scientific Reports . 6 : 28602. Bibcode :2016NatSR...628602F. doi :10.1038/srep28602. PMC 4919621 . PMID 27339599.
- ^ abcdefghi Napoli C, Benincasa G, Loscalzo J (апрель 2019 г.). «Эпигенетическое наследование, лежащее в основе легочной артериальной гипертензии». Артериосклероз, тромбоз и сосудистая биология . 39 (4): 653– 664. doi : 10.1161/ATVBAHA.118.312262. PMC 6436974. PMID 30727752 .
- ^ Weaver IC, Cervoni N, Champagne FA, D'Alessio AC, Sharma S, Seckl JR и др. (август 2004 г.). «Эпигенетическое программирование материнским поведением». Nature Neuroscience . 7 (8): 847– 854. doi :10.1038/nn1276. PMID 15220929. S2CID 1649281.
- ^ McGowan PO, Sasaki A, D'Alessio AC, Dymov S, Labonté B, Szyf M и др. (март 2009 г.). «Эпигенетическая регуляция глюкокортикоидных рецепторов в мозге человека связана с жестоким обращением в детстве». Nature Neuroscience . 12 (3): 342– 348. doi :10.1038/nn.2270. PMC 2944040 . PMID 19234457.
- ^ Meaney MJ, Szyf M (2005). «Программирование стрессовых реакций окружающей средой посредством метилирования ДНК: жизнь на стыке динамической среды и фиксированного генома». Dialogues in Clinical Neuroscience . 7 (2): 103–123 . doi :10.31887/DCNS.2005.7.2/mmeaney. PMC 3181727. PMID 16262207 .
- ^ ab Radtke KM, Ruf M, Gunter HM, Dohrmann K, Schauer M, Meyer A, Elbert T (июль 2011 г.). «Трансгенерационное влияние насилия со стороны интимного партнера на метилирование в промоторе глюкокортикоидного рецептора». Трансляционная психиатрия . 1 (19 июля): e21. doi :10.1038/tp.2011.21. PMC 3309516. PMID 22832523 .
- ^ abcd Kioumourtzoglou MA, Coull BA, O'Reilly ÉJ, Ascherio A, Weisskopf MG (июль 2018 г.). «Связь воздействия диэтилстилбестрола во время беременности с многопоколенческими дефицитами нейроразвития». JAMA Pediatrics . 172 (7): 670– 677. doi :10.1001/jamapediatrics.2018.0727. PMC 6137513 . PMID 29799929.
- ^ Jablonka E, Lamb MJ (2005). Эпигенетическое наследование и эволюция: измерение Ламарка (переиздание). Оксфорд: Oxford University Press. ISBN 978-0-19-854063-2.
- ^ Кубас П., Винсент С., Коэн Э. (сентябрь 1999 г.). «Эпигенетическая мутация, ответственная за естественные вариации симметрии цветка». Nature . 401 (6749): 157– 161. Bibcode :1999Natur.401..157C. doi :10.1038/43657. PMID 10490023. S2CID 205033495.
- ^ Дафни А, Кеван ПГ (1997). «Размер и форма цветка: влияние на опыление». Израильский журнал по растениеводству . 45 ( 2–3 ): 201–211 . Bibcode : 1997IsJPS..45..201D. doi : 10.1080/07929978.1997.10676684.
- ^ Нильссон EE, Сэдлер-Риглман I, Скиннер MK (апрель 2018 г.). «Эпигенетическое трансгенерационное наследование болезней, вызванное окружающей средой». Environmental Epigenetics . 4 (2): dvy016. doi :10.1093/eep/dvy016. PMC 6051467 . PMID 30038800.
- ^ Frazier ML, Xi L, Zong J, Viscofsky N, Rashid A, Wu EF и др. (август 2003 г.). «Связь фенотипа метилатора CpG-островка с семейным анамнезом рака у пациентов с колоректальным раком». Cancer Research . 63 (16): 4805– 4808. PMID 12941799.
- ^ Chan TL, Yuen ST, Kong CK, Chan YW, Chan AS, Ng WF и др. (октябрь 2006 г.). «Наследственная эпимутация MSH2 в зародышевой линии у семьи с наследственным неполипозным колоректальным раком». Nature Genetics . 38 (10): 1178– 1183. doi :10.1038/ng1866. PMC 7097088 . PMID 16951683.
- ^ Bossdorf O, Arcuri D, Richards CL, Pigliucci M (2010). «Экспериментальное изменение метилирования ДНК влияет на фенотипическую пластичность экологически значимых признаков Arabidopsis thaliana» (PDF) . Evolutionary Ecology . 24 (3): 541– 553. Bibcode :2010EvEco..24..541B. doi :10.1007/s10682-010-9372-7. S2CID 15763479.
- ^ Whittle CA, Otto SP, Johnston MO, Krochko JE (2009). «Адаптивная эпигенетическая память о предковом температурном режиме у Arabidopsis thaliana». Ботаника . 87 (6): 650–657 . doi : 10.1139/b09-030 .
- ^ Curley, JP, FA Champagne и P Bateson (2007) Общественное гнездование индуцирует альтернативное эмоциональное, социальное и материнское поведение у потомства. 11-я ежегодная встреча Общества поведенческой нейроэндокринологии Пасифик-Гроув, Калифорния, США. Цитируется в Branchi I (апрель 2009 г.). «Общественное гнездо мышей: исследование эпигенетических влияний ранней социальной среды на развитие мозга и поведения». Neuroscience and Biobehavioral Reviews . 33 (4): 551– 559. doi :10.1016/j.neubiorev.2008.03.011. PMID 18471879. S2CID 1592896.
- ^ Branchi I, D'Andrea I, Fiore M, Di Fausto V, Aloe L, Alleva E (октябрь 2006 г.). «Раннее социальное обогащение формирует социальное поведение и уровни фактора роста нервов и нейротрофического фактора, полученного из мозга, в мозге взрослой мыши». Biological Psychiatry . 60 (7): 690– 696. doi :10.1016/j.biopsych.2006.01.005. PMID 16533499. S2CID 16627324.
- ^ Сен, Рвик; Барнс, Кристофер (2021-05-12). «Общие эпигенетические процессы в трансгенерационном эпигенетическом наследовании и развитии иммунной системы?». Журнал биологии развития . 9 (2): 20. doi : 10.3390/jdb9020020 . ISSN 2221-3759. PMC 8162332. PMID 34065783 .
- ^ abc Кацмарски, Натали; Домингес-Андрес, Хорхе; Чирович, Бранко; Рениерис, Георгиос; Чиарло, Элеонора; Ле Рой, Дидье; Лепихов Константин; Каттлер, Кэтрин; Гаспарони, Жиль; Хендлер, Кристиан; Тайс, Хайди; Бейер, Марк; ван дер Меер, Йос ВМ; Йостен, Лео А.Б.; Вальтер, Йорн (ноябрь 2021 г.). «Передача тренированного иммунитета и гетерологичной устойчивости к инфекциям из поколения в поколение». Природная иммунология . 22 (11): 1382–1390 . doi : 10.1038/s41590-021-01052-7. hdl : 2066/241159 . ISSN 1529-2916. PMID 34663978. S2CID 239026066.
- ^ abcd Эггерт, Хендрик; Курц, Иоахим; Дидденс-де Бур, Майке Ф. (2014-12-22). «Различные эффекты отцовского трансгенерационного иммунного прайминга на выживаемость и иммунитет у потомков-матерей и генетических потомков». Труды Королевского общества B: Биологические науки . 281 (1797): 20142089. doi :10.1098/rspb.2014.2089. ISSN 0962-8452. PMC 4240996. PMID 25355479 .
- ^ Аб Сингх, Кришна П.; Джахагирдар, Шамарао; Сарма, Биринчи Кумар, ред. (2021). Новые тенденции в патологии растений. дои : 10.1007/978-981-15-6275-4. ISBN 978-981-15-6274-7. S2CID 228078200.
- ^ abc Luna, Estrella; Ton, Jurriaan (июнь 2012 г.). «Эпигенетический механизм, контролирующий трансгенерационную системную приобретенную устойчивость». Plant Signaling & Behavior . 7 (6): 615– 618. Bibcode : 2012PlSiB...7..615L. doi : 10.4161/psb.20155. ISSN 1559-2324. PMC 3442853. PMID 22580690. S2CID 38372184 .
- ^ аб Касье, Карин; Дельмар, Валери; Геген, Натали; Германт, Екатерина; Виоде, Элиза; Вори, Шанталь; Ронсере, Стефан; Брассет, Эмили; Тейссет, Лора; Бойвен, Антуан (15 марта 2019 г.). Нильсен, Тимоти В.; Мэнли, Джеймс Л. (ред.). «Эпигенетическая конверсия кластера пиРНК, вызванная окружающей средой». электронная жизнь . 8 : е39842. doi : 10.7554/eLife.39842 . ISSN 2050-084X. ПМК 6420265 . ПМИД 30875295.
- ^ ab Major, Kaley M.; DeCourten, Bethany M.; Li, Jie; Britton, Monica; Settles, Matthew L.; Mehinto, Alvine C.; Connon, Richard E.; Brander, Susanne M. (2020). «Воздействие на раннем этапе жизни экологически значимых уровней эндокринных разрушителей приводит к многопоколенческим и транспоколенческим эпигенетическим изменениям в модели рыб». Frontiers in Marine Science . 7. doi : 10.3389/fmars.2020.00471 . ISSN 2296-7745.
- ^ Лю, Шэнлинь; Тенгстедт, Ая Ноерсгаард Буур; Якобсен, Магнус В.; Пуйолар, Хосе Мартин; Йонссон, Бьярни; Лобон-Червиа, Хавьер; Бернатчес, Луи; Хансен, Майкл М. (август 2022 г.). «Полногеномное метилирование у панмиктического европейского угря (Anguilla anguilla)». Молекулярная экология . 31 (16): 4286–4306 . Бибкод : 2022MolEc..31.4286L. дои : 10.1111/mec.16586. ISSN 0962-1083. PMID 35767387. S2CID 250115270.
- ^ ab Jablonka E, Raz G (июнь 2009 г.). «Трансгенерационное эпигенетическое наследование: распространенность, механизмы и последствия для изучения наследственности и эволюции». The Quarterly Review of Biology . 84 (2): 131– 176. CiteSeerX 10.1.1.617.6333 . doi :10.1086/598822. PMID 19606595. S2CID 7233550.
- ^ Whitham TG, Slobodchikoff CN (июль 1981 г.). «Эволюция по особям, взаимодействия растений и травоядных и мозаика генетической изменчивости: адаптивное значение соматических мутаций у растений». Oecologia . 49 (3): 287– 292. Bibcode :1981Oecol..49..287W. doi :10.1007/BF00347587. PMID 28309985. S2CID 20411802.
- ^ Туриан Г (1979). «Спорогенез у грибов». Ежегодный обзор фитопатологии . 12 : 129–137 . doi :10.1146/annurev.py.12.090174.001021.
- ^ Ворциммер П (1963). «Чарльз Дарвин и смешанное наследование». Исида . 54 (3): 371–390 . doi : 10.1086/349734. S2CID 143975567.
- ^ Дженкин Ф. (1867). «Обзор Происхождения видов». North British Review .
- ^ Мендель Г (1866). «Versuche über Plflanzenhybriden. Verhandlungen des naturforschenden Vereines в Брюнне» [Эксперименты по гибридизации растений] (PDF) . Прочтите на собраниях Брюннского общества естествознания 8 февраля и 8 марта 1865 г. (на немецком языке).
- ^ Ламарк Дж. Б. (1809). Зоологическая философия: или Выставка относительных размышлений о естественной истории животных. Dentu et L'Auteur, Париж.
- ^ Bowler PJ (1989). Эволюция, история идеи . Беркли: Издательство Калифорнийского университета. ISBN 978-0-520-06386-0.
- ^ Вейсман А (1891). Poulton EB , Schönland S, Shipley E (ред.). Очерки о наследственности и родственных биологических проблемах. Oxford: Clarendon Press. doi :10.5962/bhl.title.28066.
- ^ Goldberg AD, Allis CD, Bernstein E (февраль 2007 г.). «Эпигенетика: ландшафт обретает форму». Cell . 128 (4): 635– 638. doi : 10.1016/j.cell.2007.02.006 . PMID 17320500.
- ^ Waddington CH (2016) [1939]. «Развитие как эпигенетический процесс». Введение в современную генетику. Лондон: Allen and Unwin. ISBN 9781317352037.
Одним из классических противоречий в эмбриологии было противоречие между преформистами и эпигенетиками[sic]. [...] взаимодействие этих компонентов приводит к появлению новых типов тканей и органов, которые изначально не существовали, и в этом смысле развитие следует рассматривать как «эпигенетическое».
- ^ Холлидей Р. (2006). «Эпигенетика: исторический обзор». Эпигенетика . 1 (2): 76–80 . doi : 10.4161/epi.1.2.2762 . PMID 17998809.
- ^ Nanney DL (июль 1958). «Эпигенетические системы управления». Труды Национальной академии наук Соединенных Штатов Америки . 44 (7): 712– 717. Bibcode :1958PNAS...44..712N. doi : 10.1073/pnas.44.7.712 . PMC 528649. PMID 16590265 .
- ^ Крик Ф. Х. (1958). «О синтезе белка» (PDF) . Симпозиумы Общества экспериментальной биологии . 12 : 138–163 . PMID 13580867.
- ^ Pigliucci M (декабрь 2007 г.). «Нужен ли нам расширенный эволюционный синтез?». Эволюция; Международный журнал органической эволюции . 61 (12): 2743– 2749. doi : 10.1111/j.1558-5646.2007.00246.x . PMID 17924956.
- ^ abcd van Otterdijk SD, Michels KB (июль 2016 г.). «Трансгенерационное эпигенетическое наследование у млекопитающих: насколько хороши доказательства?». FASEB Journal . 30 (7): 2457– 65. doi : 10.1096/fj.201500083 . PMID 27037350. S2CID 11969347.
- ^ Стил Э. Дж. (1979). Соматический отбор и адаптивная эволюция: о наследовании приобретенных признаков (1-е изд.). Торонто: Williams-Wallace.
- ^ Стил Э.Дж. , Линдли РА, Бланден Р.В. (1998). Дэвис П. (ред.). Подпись Ламарка: как ретрогены меняют парадигму естественного отбора Дарвина . Frontiers of Science. Сидней: Allen & Unwin.
- ^ Линдли РА (2010). Сома: как на самом деле работают наши гены и как это все меняет! . Пиара Уотерс, CYO Foundation. ISBN 978-1451525649.
- ^ Steele EJ , Lloyd SS (май 2015 г.). «Обратная связь между сомой и зародышевой линией подразумевается экстремальным полиморфизмом в IGHV относительно MHC: явный полиморфизм MHC, по-видимому, значительно превышается в локусах иммуноглобулина, что позволяет предположить, что антиген-селектированные соматические мутанты V проникают через барьер Вейсмана». BioEssays . 37 (5): 557– 569. doi :10.1002/bies.201400213. PMID 25810320. S2CID 1270807.
- ^ Steele EJ (2016). Levin M, Adams DS (ред.). Происхождение врожденных дефектов: стабильное наследование по мужской линии через материнские антитела, специфичные для антигенов хрусталика глаза, вызывающих аутоиммунные дефекты глаз у развивающихся кроликов в утробе матери . Опережая кривую - Скрытые прорывы в биологических науках. Бристоль, Великобритания: IOP Publishing. стр. Глава 3.
- ^ Хойл Ф. , Викрамасингх К. (1982). Почему неодарвинизм не работает . Кардифф: University College Cardiff Press. ISBN 0-906449-50-2.
- ^ Хойл Ф. , Викрамасингхе NC (1979). Болезни из космоса . Лондон: JM Dent.
- ^ Хойл Ф. , Викрамасингхе NC (1981). Эволюция из космоса . Лондон: JM Dent.
- ^ Лю И (сентябрь 2007 г.). «Каков отец, таков и сын. Свежий обзор наследования приобретенных признаков». EMBO Reports . 8 (9): 798– 803. doi :10.1038/sj.embor.7401060. PMC 1973965. PMID 17767188 .
- ^ Liu Y, Li X (май 2016). «Паногенез Дарвина как молекулярная теория наследственных заболеваний». Gene . 582 (1): 19– 22. doi :10.1016/j.gene.2016.01.051. PMID 26836487.
- ^ Noble D (февраль 2012 г.). «Теория биологической относительности: нет привилегированного уровня причинности». Interface Focus . 2 (1): 55– 64. doi :10.1098/rsfs.2011.0067. PMC 3262309. PMID 23386960 .
- ^ Noble D (август 2013 г.). «Физиология потрясает основы эволюционной биологии». Experimental Physiology . 98 (8): 1235–1243 . doi : 10.1113/expphysiol.2012.071134 . PMID 23585325. S2CID 19689192.
- ^ Mattick JS (октябрь 2012 г.). «Rocking the foundations of molecular genetics». Труды Национальной академии наук Соединенных Штатов Америки . 109 (41): 16400– 16401. Bibcode : 2012PNAS..10916400M. doi : 10.1073/pnas.1214129109 . PMC 3478605. PMID 23019584 .
