Диборан(2)
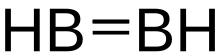 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Диборен | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
| |
| |
| Характеристики | |
| В 2 Н 2 | |
| Молярная масса | 23,64 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Диборан(2) , также известный как диборен , является неорганическим соединением с формулой B2H2 . Число 2 в диборане(2) указывает на количество атомов водорода , связанных с комплексом бора . Существуют и другие формы диборана с различным количеством атомов водорода, включая диборан (4) и диборан(6) .
Диборан(2) — это высокореактивная молекула, которая быстро распадается, что делает ее изучение экспериментальным путем в условиях окружающей среды сложной задачей. Для экспериментального наблюдения диборана(2) требуются условия высокого вакуума и низкой температуры с использованием методов матричной изоляции , таких как улавливание молекулы в инертных матрицах, таких как неон или аргон . [1] [2] В результате этих сложных условий синтеза ее свойства и поведение в основном изучались с использованием теоретических моделей и компьютерного моделирования .
Диборен также относится к серии молекул с формулой R:(BH)=(BH):R или RB=BR, где R — органическая группа . [3] [4] Производные диборена относительно стабильны и могут храниться при комнатной температуре в инертных условиях. Они были синтезированы и охарактеризованы экспериментально и показали потенциал в различных приложениях.
Синтез
Первый эксперимент, который привел к синтезу диборана(2), был проведен с помощью импульсной лазерной абляции бора в смешанной атмосфере водорода и аргона . [1] При охлаждении смеси аргоновый газ превратился в твердое вещество , тем самым стабилизировав захваченные дибораны. В реакции участвовали два моногидрида бора, которые объединялись для образования диборана(2), причем реакция была экзотермической на 117 ккал/моль. Диборан(2) характеризовался широкой полосой с острым пиком при 2679,9 см –1 , что соответствует антисимметричной моде растяжения BH.
После этого эксперимента появились другие методы получения диборана(2) путем разложения газообразного B2H6 посредством фотоионизации , электронной бомбардировки , рентгеновского облучения , высокотемпературных реакций и импульсного лазерного испарения . [2]
Поскольку производные диборена более стабильны, чем диборан(2), для их синтеза использовались различные методы. В первую очередь они были получены путем реакции соединений диборена с органическими молекулами и восстановления предшественников , содержащих бор . [5] [6] Кроме того, группа диборена может быть защищена подходящим лигандом , что предотвращает другие побочные реакции. [7]
Структура и свойства
Для определения структуры и свойств диборана(2) было использовано сочетание экспериментальных и теоретических данных.
Теоретические данные показали, что молекула имеет конформацию основного состояния 3 Σ - g , что указывает на особую ориентацию с тройной вращательной симметрией и вертикальной зеркальной плоскостью . [8] Она сохраняет свою структуру при повороте на 180 градусов вокруг оси, перпендикулярной зеркальной плоскости, и имеет точечную группу симметрии D ∞ h .
Эти теоретические данные были подтверждены экспериментально, что показало, что молекула является линейной с триплетным основным состоянием, как показал электронный парамагнитный резонанс . [2] Исследование отметило, что молекула похожа на ацетилен , с одним электроном , удаленным из каждой из молекулярных орбиталей пи. Таким образом, молекулярная орбитальная диаграмма содержит электроны на трех орбиталях ; включая орбиталь сигма-связи со спаренными электронами на самом низком энергетическом уровне и две вырожденные орбитали пи-связи , каждая из которых имеет неспаренный электрон. Таким образом, связь BB имеет характер частичной двойной связи, что объясняет высокую реакционную способность этих соединений.
Приложения
Диборены имеют потенциальное применение в материаловедении , катализе и химии устойчивой энергетики .
Согласно теоретическим исследованиям, диборан(2) имеет потенциальные применения в наноустройствах . Предсказано, что наноленты диборана(2) структурно стабильны и полупроводниковы благодаря гибкой настраиваемости зоны. [9] Другое теоретическое исследование разработало основанную на оптимизации методику для проектирования и анализа системы B2H2 , которая использует биомассу для производства водорода, что, как они обнаружили, может быть жизнеспособным вариантом для устойчивой энергетической системы. [10]
Производные диборена широко использовались в катализе. Было обнаружено, что они катализируют реакции гидроборирования , причем реакция является хемоселективной . [11] Кроме того, диборены могут подвергаться реакциям неорганического-органического кросс-метатезиса, давая комплекс, допированный B,N. [12]
Ссылки
- ^ ab Tague, Thomas J.; Andrews, Lester (1994). «Реакции атомов бора, испаренных импульсным лазером, с водородом. Инфракрасные спектры промежуточных видов гидрида бора в твердом аргоне». Журнал Американского химического общества . 116 (11): 4970–4976. doi :10.1021/ja00090a048. ISSN 0002-7863.
- ^ abc Knight, Lon B.; Kerr, Kelly; Miller, PK; Arrington, CA (1995). "Исследование методом ЭПР радикала HBBH(X3.SIGMA.) в матрицах неона и аргона при 4 К. Сравнение с расчетами ab Initio SCF и CI". Журнал физической химии . 99 (46): 16842–16848. doi :10.1021/j100046a009. ISSN 0022-3654.
- ^ Ван, Юйчжун; Куиллиан, Брэндон; Вэй, Пингронг; Ваннере, Чайтанья С.; Се, Яомин; Кинг, Р. Брюс; Шефер, Генри Ф.; Шлейер, Пол в. Р.; Робинсон, Грегори Х. (2007-10-01). «Стабильный нейтральный диборен, содержащий двойную связь BB». Журнал Американского химического общества . 129 (41): 12412–12413. doi :10.1021/ja075932i. ISSN 0002-7863. PMID 17887683.
- ^ Бортакур, Росмита; Саха, Кошик; Кар, Сурав; Гош, Сундаргопал (15 ноября 2019 г.). «Последние достижения в химии диборана (6), диборана (4) и диборена (2) переходных металлов». Обзоры координационной химии . 399 : 213021. doi : 10.1016/j.ccr.2019.213021. ISSN 0010-8545. S2CID 202880767.
- ^ Okorn, Alexander; Jayaraman, Arumugam; Englert, Lukas; Arrowsmith, Merle; Swoboda, Theresa; Weigelt, Jeanette; Brunecker, Carina; Hess, Merlin; Lamprecht, Anna; Lenczyk, Carsten; Rang, Maximilian; Braunschweig, Holger (2022-06-29). "Синтез и гидрирование полициклических ароматических углеводород-замещенных диборенов с помощью некатализируемого гидрогенизационного расщепления связи B–C". Chemical Science . 13 (25): 7566–7574. doi :10.1039/D2SC02515A. ISSN 2041-6539. PMC 9242019 . PMID 35872817.
- ^ Лу, Вэй; Джаяраман, Арумугам; Фантуцци, Фелипе; Дьюхерст, Райан Д.; Хертерих, Марсель; Дитц, Максимилиан; Хагшпиль, Стефан; Крумменахер, Иво; Хаммонд, Кай; Цуй, Цзинцзин; Брауншвейг, Хольгер (17 января 2022 г.). «Несимметричный циклический диборен на основе хелатирующего лиганда CAAC и его низкомолекулярной активации и химии перегруппировки». Angewandte Chemie, международное издание . 61 (3): e202113947. дои : 10.1002/anie.202113947. ISSN 1433-7851. ПМЦ 9299934 . ПМИД 34750945.
- ^ Биссинджер, Филипп; Брауншвейг, Хольгер; Челик, Мехмет Али; Клаас, Кристина; Дьюхерст, Райан Д.; Эндрес, Себастьян; Кельх, Хауке; Крамер, Томас; Крумменахер, Иво; Шнайдер, Кристоф (22 октября 2015 г.). «Синтез циклических диборенов с беспрецедентной цис-конфигурацией». Химические коммуникации . 51 (88): 15917–15920. дои : 10.1039/C5CC07103H. ISSN 1364-548X. ПМИД 26360103.
- ^ Дилл, Дж. Д.; Шлейер, П. в. Р.; Попл, Дж. А. (1975). «Молекулярная орбитальная теория электронной структуры органических соединений. XXIV. Геометрия и энергия малых соединений бора. Сравнение с карбокатионами». Журнал Американского химического общества . 97 (12): 3402–3409. doi :10.1021/ja00845a021. ISSN 0002-7863.
- ^ Чо, Сольхи; У, Ён-бин; Ким, Бён Су; Ким, Джиён (01.04.2016). «Планирование на основе оптимизации системы переработки биомассы в водород (B2H2) с использованием специальных энергетических культур и отходов биомассы». Биомасса и биоэнергетика . 87 : 144–155. Bibcode : 2016BmBe...87..144C. doi : 10.1016/j.biombioe.2016.02.025. ISSN 0961-9534.
- ^ Лей, Бао; Чжан, Ю-Ян; Ду, Ши-Сюань (2019). «Лентовая инженерия нанолент B 2 H 2». Китайская физика Б. 28 (4): 046803. дои : 10.1088/1674-1056/28/4/046803. ISSN 1674-1056. S2CID 250797835.
- ^ Фань, Цзюнь; Мах, Цзянь-Цян; Ян, Мин-Чунг; Су, Мин-Дер; Со, Чеук-Вай (2021-04-07). «AN -Phosphinoamidinato NHC-Diborene Catalyst for Hydroboration». Журнал Американского химического общества . 143 (13): 4993–5002. doi : 10.1021/jacs.0c12627. hdl : 10356/149733 . ISSN 0002-7863. PMID 33448848. S2CID 231611304.
- ^ Хертерих, Марсель; Ритчел, Бенедикт; Эроусмит, Мерл; Бёнке, Джулиан; Крумменахер, Иво; Пхукан, Ашвини К.; Брауншвейг, Хольгер (3 ноября 2021 г.). «Гибридный неорганически-органический перекрестный метатезис диборенов и ацетилена». Журнал Американского химического общества . 143 (43): 18339–18345. doi : 10.1021/jacs.1c10131. ISSN 0002-7863. PMID 34677063. S2CID 239457905.