Дельфинит
 | |
 | |
| Имена | |
|---|---|
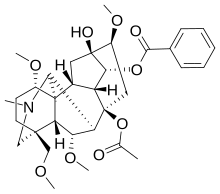
| Другие имена 8-(Ацетилокси)-13-гидрокси-1,6,16-триметокси-4-(метоксиметил)-20-метилаконитан-14-ил бензоат | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.008.377 |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С 33 Н 45 НЕТ 9 | |
| Молярная масса | 599.712 |
| Появление | бесцветное твердое вещество |
| Температура плавления | 197–199 °C (387–390 °F; 470–472 K) |
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | Токсичный |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Дельфинин — токсичный дитерпеноидный алкалоид , содержащийся в растениях родов Delphinium (живокост) и Atragene (ломонос), оба из семейства Ranunculaceae . [1] Дельфинин — основной алкалоид, содержащийся в семенах Delphinium staphisagria — в свое время под названием stavesacre, очень известном растительном средстве от вшей. [2] Он похож по структуре на аконитина и обладает схожими эффектами , действуя как аллостерический модулятор потенциалзависимых натриевых каналов , [3] и вызывая низкое кровяное давление , замедление сердечного ритма и аномальные сердечные ритмы . Эти эффекты делают его крайне ядовитым ( LD 50 1,5–3,0 мг/кг у кроликов и собак; лягушки примерно в 10 раз более восприимчивы). [4] Хотя он использовался в некоторых альтернативных лекарствах (например, в фитотерапии [5] [6] ), большая часть медицинского сообщества не рекомендует его использовать из-за его чрезвычайной токсичности.
Изоляция
Одним из самых ранних отчетов об изоляции дельфинина из D. staphisagria был отчет французских химиков Лассэня и Фенеля от 1819 года. [7] Менее древний и более доступный отчет принадлежит химику из Министерства сельского хозяйства США Л. Н. Марквуду, который также кратко рассмотрел более ранние работы по изоляции. [8] Примечательно, что эти ранние выделения проводились без помощи хроматографии , поскольку дельфинин легко кристаллизуется из экстракта петролейного эфира после типичного кислотно-щелочного цикла, используемого в традиционных методах экстракции растительных алкалоидов. [9]
Химия
Несмотря на относительную простоту выделения и раннего открытия дельфинина, его молекулярная структура не была установлена в ее нынешней общепринятой форме до начала 1970-х годов. В то время исследовательская группа Визнера исправила стереохимию метоксигруппы в положении C-1 с β- на α- конфигурацию . [10] [11] Таким образом, любой рисунок молекулы дельфинина, появившийся до 1971–1972 годов, вероятно, будет показывать неправильную стереохимию в положении C-1.
Фармакология
В результате его раннего открытия и выделения в кристаллической форме (тогда считавшейся критерием чистоты) фармакологические свойства дельфинина были широко исследованы в 19 веке, несмотря на то, что его молекулярная структура была неизвестна. Вероятно, что некоторые из этих исследований проводились с неочищенным препаратом и должны интерпретироваться с осторожностью. Ссылки и комментарии к этим ранним исследованиям можно найти в обзоре Бенна и Джасино. [4] Более поздние исследования были сосредоточены на сердечно-сосудистой токсичности дельфинина. [12] [13]
В целом фармакология дельфинина, по-видимому, напоминает фармакологию аконитина , хотя острая токсичность дельфинина, по-видимому, ниже, чем у аконитина у подопытных животных. [4]
Ссылки
- ^ Harbourne JB, Baxter H, ред. (1993). Фитохимический словарь . Лондон: Taylor & Francis. стр. 148.
- ^ «Современный травник | Stavesacre».
- ^ Турабекова МА, Расулев БФ, Левкович МГ, Абдуллаев НД, Лещинский Дж (апрель 2008 г.). "Алкалоиды Aconitum и Delphinium sp. как антагонисты-модуляторы потенциалзависимых Na+-каналов. Исследования электронной структуры AM1/DFT и исследования QSAR". Computational Biology and Chemistry . 32 (2): 88– 101. doi :10.1016/j.compbiolchem.2007.10.003. PMC 5001567 . PMID 18201930.
- ^ abc Benn MH, Jacyno JM (1983). Pelletier SW (ред.). "Глава 4". Алкалоиды: химические и биологические перспективы . 1. Нью-Йорк: Wiley: 153–210 .
- ^ Desai HK, Hart BP, Caldwell RW, Jianzhong-Huang JH, Pelletier SW (июнь 1998 г.). «Некоторые нордитерпеноидные алкалоиды и их сердечно-сосудистое действие». Journal of Natural Products . 61 (6): 743– 8. doi :10.1021/np970499j. PMID 9644057.
- ^ Диас Х. Г., Руис Х. Г., де Ла Фуэнте Г. (август 2000 г.). «Алкалоиды из Delphinium staphisagria». Журнал натуральных продуктов . 63 (8): 1136– 9. doi :10.1021/np990453l. PMID 10978212.
- ^ Лассень JL, Фенёль H (1819). «Анализ стафизагра». Энн. Хим. Физ . Серия 2. 12 : 358–71 .
- ^ Markwood LN (октябрь 1927 г.). «Выделение масла и алкалоидов из семян ставасакра (Delphinium staphisagria)». Журнал Американской фармацевтической ассоциации . 16 (10): 928–32 . doi :10.1002/jps.3080161006.
- ^ Jacobs WA, Craig LC (февраль 1939). "DELPHININE". Журнал биологической химии . 127 (2): 361– 6. doi : 10.1016/S0021-9258(18)73787-3 .
- ^ Aneja R, Locke DM, Pelletier SW (январь 1973). «Дитерпеновые алкалоиды: структура и стереохимия гетероатизина». Tetrahedron . 29 (21): 3297– 308. doi :10.1016/S0040-4020(01)93482-9.
- ^ Pelletier SW, Wright LH (январь 1972). "Последние разработки в химии дитерпеноидных алкалоидов". Алкалоиды . Т. 2. Лондон: The Chemical Society. стр. 247–258 (254–255). doi :10.1039/9781847555588-00247. ISBN 978-0-85186-267-5.
- ^ Scherf D, Blumenfeld S, Tander D, Yildiz M (декабрь 1960 г.). «Влияние дифенилгидантоина (дилантина) натрия на трепетание и фибрилляцию предсердий, вызванные фокальным применением конитина или дельфинина». American Heart Journal . 60 (6): 936– 47. doi :10.1016/0002-8703(60)90125-3. PMID 13747515.
- ^ Шерф Д., Шотт А. (1973). Экстрасистолы и родственные аритмии (2-е изд.). Лондон: Хайнеманн.


