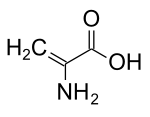
Дегидроаланин
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 2-аминопроп-2-еновая кислота | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ | |
| ChemSpider | |
| DrugBank | |
| КЕГГ | |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С3Н5НО2 | |
| Молярная масса | 87,08 г/моль |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Дегидроаланин ( Cα,β-дидегидроаланин , α,β-дидегидроаланин , 2-аминоакрилат или 2,3-дидегидроаланин ) — дегидроаминокислота . Она не существует в свободной форме, но встречается в природе в виде остатка, обнаруженного в пептидах микробного происхождения . [1] Как аминокислотный остаток она необычна, поскольку имеет ненасыщенный остов. [2]
Структура и реакционная способность
Как и большинство первичных енаминов , дегидроаланин нестабилен. Дегидроаланин гидролизуется до пирувата .
N -Ацилированные производные дегидроаланина, такие как пептиды и родственные соединения, стабильны. Например, метил-2-ацетамидоакрилат является N-ацетилированным производным эфира. Как остаток в пептиде, он генерируется путем посттрансляционной модификации . Требуемыми предшественниками являются остатки серина или цистеина , которые подвергаются ферментативно-опосредованной потере воды и сероводорода соответственно.
Большинство аминокислотных остатков не реагируют с нуклеофилами , но те, которые содержат дегидроаланин или некоторые другие дегидроаминокислоты, являются исключениями. Они электрофильны из-за α,β-ненасыщенного карбонила , [2] и могут, например, алкилировать другие аминокислоты. Эта активность сделала DHA полезным синтетически для получения лантионина .
Происшествие
Остаток дегидроаланина был впервые обнаружен в низине , циклическом пептиде с антимикробной активностью. [2] Дегидроаланин также присутствует в некоторых лантибиотиках и микроцистинах .
DHA может быть образована из цистеина или серина путем простого основного катализа без необходимости фермента, что может происходить во время приготовления пищи и щелочных процессов приготовления пищи. Затем он может алкилировать другие аминокислотные остатки, такие как лизин , образуя лизиновые поперечные связи и рацемизацию исходного аланина. Полученные белки имеют более низкую пищевую ценность для некоторых видов, но более высокую пищевую ценность для других. Некоторые лизиновые аланины также могут вызывать увеличение почек у крыс. [3]
Многие пептиды, содержащие дегидроаланин, токсичны. [2]

Долгое время считалось, что остаток дегидроаланина является важным электрофильным каталитическим остатком в ферментах аммиак-лиаза гистидина и аммиак-лиаза фенилаланин , но позднее было обнаружено, что активный остаток представляет собой другое ненасыщенное производное аланина — 3,5-дигидро-5-метилдиен-4H-имидазол-4-он — который является еще более электрофильным. [4] [5]
Химический синтез
Производные N-ацилдегидроаланина были синтезированы путем дегидратации серинов с использованием трет -бутоксикарбонатной уходящей группы [6] или путем преобразования производных цистеина с использованием различных реагентов для устранения тиоловой группы [7] .
Новейшие методы позволяют осуществлять синтез в граммовых количествах различных защищенных дегидроаминокислот путем электрохимического окисления соответствующего производного аминокислоты в метаноле с последующим катализируемым кислотой устранением метанола. [8]
Ссылки
- ^ Даунс, Д.М.; Эрнст, Д.К. (апрель 2015 г.). «От микробиологии к биологии рака: семейство белков Rid предотвращает повреждение клеток, вызванное эндогенно генерируемыми активными формами азота». Молекулярная микробиология . 96 (2): 211– 9. doi :10.1111/mmi.12945. PMC 4974816. PMID 25620221 .
- ^ abcd Siodłak, Dawid (2015). "α,β-дегидроаминокислоты в природных пептидах". Аминокислоты . 47 (1): 1– 17. doi :10.1007/s00726-014-1846-4. PMC 4282715. PMID 25323736 .
- ^ Фридман, Мендель (1999). «Лизиноаланин в пищевых продуктах и в антимикробных белках». В Джексон, Лорен С.; Книз, Марк Г.; Морган, Джеффри Н. (ред.). Влияние обработки на безопасность пищевых продуктов . Достижения в экспериментальной медицине и биологии. Т. 459. Springer. С. 145–159 . doi :10.1007/978-1-4615-4853-9_10. ISBN 978-1-4615-4853-9. PMID 10335374.
- ^ Ретей, Янош (2003). «Открытие и роль метилиденимидазолона, высокоэлектрофильной простетической группы». Biochimica et Biophysica Acta (BBA) - Белки и протеомика . 1647 ( 1– 2): 179– 184. doi :10.1016/S1570-9639(03)00091-8. PMID 12686130.
- ^ Calabrese JC, Jordan DB, Boodhoo A, Sariaslani S, Vannelli T (сентябрь 2004 г.). «Кристаллическая структура фенилаланиновой аммиачной лиазы: множественные спиральные диполи, вовлеченные в катализ». Биохимия . 43 (36): 11403– 16. doi :10.1021/bi049053+. PMID 15350127.
- ^ Феррейра, Паула М.Т.; Майя, Эрнани Л.С.; Монтейро, Луис С.; Сакраменто, Джоана (1999). «Высокопродуктивный синтез производных дегидроаминокислот и дегидропептидов». Журнал Химического общества, Perkin Transactions 1 (24): 3697–3703 . doi : 10.1039/a904730a. HDL : 1822/2188 .
- ^ Chalker, Justin M.; Gunnoo, Smita B.; Boutureira, Omar; Gerstberger, Stefanie C.; Fernández-González, Marta; Bernardes, Gonçalo JL; Griffin, Laura; Hailu, Hanna; Schofield, Christopher J.; Davis, Benjamin G. (2011). "Методы преобразования цистеина в дегидроаланин в пептидах и белках". Chemical Science . 2 (9): 1666. doi :10.1039/c1sc00185j. ISSN 2041-6520.
- ^ Гаусманн, Марсель; Крейдт, Надин; Кристманн, Матиас (2023-04-07). «Электросинтез защищенных дегидроаминокислот». Organic Letters . 25 (13): 2228– 2232. doi :10.1021/acs.orglett.3c00403. ISSN 1523-7060. PMID 36952622. S2CID 257716096.


