переворачивание оснований ДНК
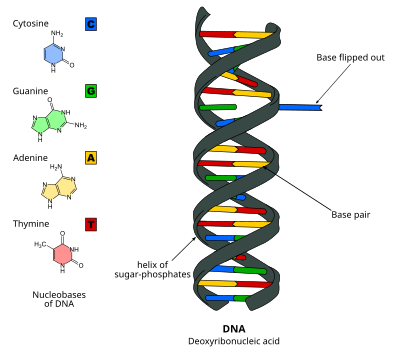
Переворот основания ДНК , или переворот нуклеотида , представляет собой механизм, при котором одно нуклеотидное основание, или нуклеиновое основание , поворачивается за пределы двойной спирали нуклеиновой кислоты. [1] Это происходит, когда ферменту , обрабатывающему нуклеиновую кислоту, требуется доступ к основанию для выполнения работы над ним, например, его вырезания для замены другим основанием во время репарации ДНК . Впервые это наблюдалось в 1994 году с помощью рентгеновской кристаллографии в ферменте метилтрансферазе , катализирующем метилирование цитозинового основания в ДНК. С тех пор было показано, что оно используется различными ферментами во многих биологических процессах, таких как метилирование ДНК , различные механизмы репарации ДНК и репликация ДНК . Это также может происходить в двойных спиралях РНК [2] или в промежуточных соединениях ДНК:РНК, образующихся во время транскрипции РНК .
Переворачивание оснований ДНК происходит путем разрыва водородных связей между основаниями и отсоединения основания от его соседей. Это может происходить посредством активного процесса, когда фермент связывается с ДНК, а затем облегчает вращение основания, или пассивного процесса, когда основание спонтанно выворачивается, и это состояние распознается и связывается ферментом. Его можно обнаружить с помощью рентгеновской кристаллографии , ЯМР-спектроскопии , флуоресцентной спектроскопии или гибридизационных зондов .
Открытие
Переворачивание оснований впервые наблюдалось в 1994 году, когда исследователи Климасаускас, Кумар, Робертс и Ченг использовали рентгеновскую кристаллографию для наблюдения за промежуточным этапом химической реакции метилтрансферазы, связанной с ДНК . [3] Метилтрансфераза, которую они использовали, была C5-цитозинметилтрансферазой из Haemophilus haemolyticus (M. HhaI). Этот фермент распознает определенную последовательность ДНК (5'-GCGC-3') и метилирует первое основание цитозина последовательности в его положении C5. [3] После кристаллизации комплекса M. HhaI-ДНК они увидели, что целевое основание цитозина было полностью повернуто из двойной спирали и было расположено в активном центре M. HhaI. Оно удерживалось на месте многочисленными взаимодействиями между M. HhaI и ДНК. [3]
Авторы предположили, что переворот основания — это механизм, используемый многими другими ферментами, такими как геликазы , ферменты рекомбинации , РНК-полимеразы , ДНК-полимеразы и топоизомеразы типа II . [3] За годы, прошедшие после этого открытия, было проведено много исследований, и было обнаружено, что переворот основания — это механизм, используемый во многих биологических процессах, которые предполагают авторы. [4] [5] [6]
Механизм

Нуклеотиды ДНК удерживаются вместе водородными связями , которые относительно слабы и могут быть легко разорваны. Переворот основания происходит в течение миллисекунд [7] путем разрыва водородных связей между основаниями и отсоединения основания от его соседей. [8] Основание поворачивается из двойной спирали на 180 градусов, [9] как правило, через большую бороздку , [10] и в активный центр фермента. Это открытие приводит к небольшим конформационным изменениям в остове ДНК [11] , которые быстро стабилизируются за счет усиления взаимодействий фермент-ДНК. [12] Исследования, изучающие профили свободной энергии переворота основания, показали, что барьер свободной энергии для переворота может быть снижен на 17 ккал/моль для M.HhaI в закрытой конформации . [10]
Существует два механизма переворачивания оснований ДНК: активный и пассивный. [13] В активном механизме фермент связывается с ДНК, а затем активно вращает основание, в то время как в пассивном механизме поврежденное основание сначала спонтанно вращается, а затем распознается и связывается ферментом. [8] Исследования продемонстрировали оба механизма: урацил-ДНК-гликозилаза следует пассивному механизму [8] , а транспозаза Tn10 следует активному механизму. [14]
Более того, исследования показали, что переворачивание оснований ДНК используется многими различными ферментами в различных биологических процессах, таких как метилирование ДНК , различные механизмы репарации ДНК , транскрипция РНК и репликация ДНК . [4] [5] [6]
Биологические процессы
Модификация и восстановление ДНК

ДНК может иметь мутации , которые приводят к повреждению основания в цепи ДНК. Чтобы обеспечить генетическую целостность ДНК, ферменты должны восстанавливать любые повреждения. Существует много типов репарации ДНК . Репарация с эксцизией оснований использует переворачивание оснований для переворачивания поврежденного основания из двойной спирали [5] в карман специфичности гликозилазы , которая гидролизует гликозидную связь и удаляет основание. [15] ДНК-гликозилазы взаимодействуют с ДНК, переворачивая основания для определения несоответствия. Пример репарации с эксцизией оснований происходит, когда основание цитозина дезаминируется и становится основанием урацила. Это вызывает ошибочную пару U:G, которая обнаруживается урацил-ДНК-гликозилазой . Основание урацила переворачивается в активный карман гликозилазы, где оно удаляется из цепи ДНК. [16] Переворачивание оснований используется для исправления мутаций, таких как 8-оксогуанин (oxoG) [17] и димеры тимина, созданные УФ-излучением. [15] [18]
Репликация, транскрипция и рекомбинация
Репликация ДНК и транскрипция РНК используют переворачивание оснований. [5] ДНК-полимераза — это фермент, который осуществляет репликацию. Ее можно представить как руку, которая захватывает шаблон одноцепочечной ДНК. [15] Когда шаблон проходит через область ладони полимеразы, основания шаблона переворачиваются из спирали и от сайта связывания dNTP . [19] Во время транскрипции РНК-полимераза катализирует синтез РНК. Во время фазы инициации два основания в элементе -10 переворачиваются из спирали и попадают в два кармана в РНК-полимеразе. Эти новые взаимодействия стабилизируют элемент -10 и способствуют разделению или расплавлению цепей ДНК. [15] [20]
Переворачивание оснований происходит на последних стадиях рекомбинации . [21] RecA — это белок, который способствует инвазии нитей [15] во время гомологичной рекомбинации . Переворачивание оснований было предложено как механизм, с помощью которого RecA может позволить одной нити распознавать гомологию в дуплексной ДНК. [22] Другие исследования показывают, что он также участвует в рекомбинации V(D)J . [23]
метилирование ДНК
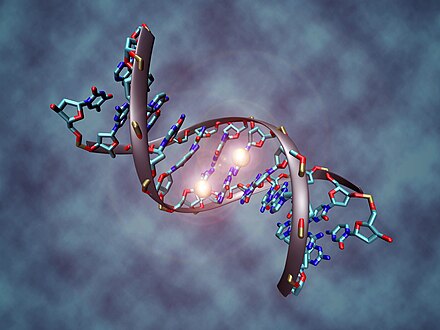
Метилирование ДНК — это процесс, в котором метильная группа добавляется либо к цитозину , либо к аденину . [24] Этот процесс вызывает активацию или инактивацию экспрессии генов , тем самым приводя к регуляции генов в эукариотических клетках. Известно также, что процесс метилирования ДНК участвует в формировании определенных типов рака . [25] [26] [27] Для того чтобы произошла эта химическая модификация, необходимо, чтобы целевое основание вывернулось из двойной спирали ДНК, чтобы позволить метилтрансферазам катализировать реакцию. [5]
Распознавание мишени эндонуклеазами рестрикции
Рестрикционные эндонуклеазы, также известные как рестриктазы, являются ферментами, которые расщепляют сахарофосфатный остов ДНК в определенных последовательностях нуклеотидов , которые обычно имеют длину от четырех до шести нуклеотидов. [28] Исследования, проведенные Хортоном и коллегами, показали, что механизм, с помощью которого эти ферменты расщепляют ДНК, включает в себя переворачивание оснований, а также изгиб ДНК и расширение малой бороздки . [29] В 2006 году Хортон и коллеги представили доказательства рентгеновской кристаллографии , показывающие, что рестрикционная эндонуклеаза HinP1I использует переворачивание оснований для распознавания своей целевой последовательности. Известно, что этот фермент расщепляет ДНК в палиндромной тетрануклеотидной последовательности G↓CGC.
Экспериментальные подходы к обнаружению
рентгеновская кристаллография
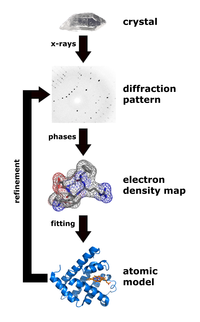
Рентгеновская кристаллография — это метод, который измеряет углы и интенсивности кристаллических атомов для определения атомной и молекулярной структуры интересующего кристалла. Затем кристаллографы могут создать трехмерную картину, на которой можно определить положения атомов , химические связи , а также другие важные характеристики. [30] Климасаукас и его коллеги использовали этот метод для наблюдения явления переворота первой базы, в котором их экспериментальная процедура включала несколько этапов: [3]
- Очищение
- Кристаллизация
- Сбор данных
- Определение и уточнение структуры
Во время очистки метилтрансфераза Haemophilus haemolyticus была сверхэкспрессирована и очищена с использованием этапа обратной экстракции с высоким содержанием соли для селективной солюбилизации M.HhaI, за которым последовала быстрая жидкостная хроматография белков ( FPLC ), как это ранее делали Кумар и коллеги. [31] Авторы использовали анионообменную колонку Mono-Q для удаления небольшого количества белковых материалов и нежелательной ДНК перед этапом кристаллизации. После успешной очистки M.HhaI образец затем выращивали с использованием метода, который смешивает раствор, содержащий комплекс, при температуре 16 °C, и метода диффузии паров в висячей капле для получения кристаллов. Затем авторы смогли собрать рентгеновские данные в соответствии с методом, использованным Ченгом и коллегами в 1993 году. [32] Этот метод включал измерение интенсивности дифракции на детекторе FAST, где время экспозиции для вращения на 0,1° составляло 5 или 10 секунд. Для определения и уточнения структуры Климасаукас и его коллеги использовали молекулярную замену уточненной структуры апо, описанной Ченгом и его коллегами в 1993 году [32] , где для решения функций вращения и трансляции использовались модели поиска X-PLOR , MERLOT и TRNSUM. [33] [34] Эта часть исследования включает использование разнообразного программного обеспечения и компьютерных алгоритмов для решения структур и характеристик интересующего кристалла.
ЯМР-спектроскопия
Спектроскопия ЯМР — это метод, который использовался на протяжении многих лет для изучения важных динамических аспектов переворота оснований. Этот метод позволяет исследователям определять физические и химические свойства атомов и других молекул, используя магнитные свойства атомных ядер . [35] Кроме того, ЯМР может предоставить разнообразную информацию, включая структуру, состояния реакции , химическое окружение молекул и динамику. [36] [37] Во время эксперимента по обнаружению переворота оснований ДНК исследователи использовали спектроскопию ЯМР для исследования переворота оснований метилтрансферазы HhaI, вызванного ферментом. Для выполнения этого эксперимента два остатка 5-фторцитозина были включены в целевое и исходное положение с субстратом ДНК, чтобы можно было выполнить анализ химического сдвига 19 F. После оценки анализа химического сдвига 19 F был сделан вывод, что комплексы ДНК существуют с несколькими формами целевого 5-фторцитозина вдоль пути переворота оснований. [38]
Флуоресцентная спектроскопия
Флуоресцентная спектроскопия — это метод, который используется для анализа образца с использованием флуоресцентного зонда. Сами по себе нуклеотиды ДНК не являются хорошими кандидатами для этого метода, поскольку они нелегко повторно испускают свет при возбуждении светом. [39] Для обнаружения переворота оснований необходим флуоресцентный маркер. 2-аминопурин — это основание, которое структурно похоже на аденин , но очень флуоресцентно при перевороте из дуплекса ДНК. [40] Он обычно используется для обнаружения переворота оснований и имеет возбуждение при 305‑320 нм и испускание при 370 нм, так что он хорошо отделен от возбуждений белков и ДНК. Другие флуоресцентные зонды, используемые для изучения переворота оснований ДНК, — это 6MAP (4-амино-6-метил-7(8H)-птеридон) [41] и Pyrrolo-C (3-[β-D-2-рибофуранозил]-6-метилпирроло[2,3-d]пиримидин-2(3H)-он). [42] [43] Флуоресцентная спектроскопия с временным разрешением также используется для получения более подробной картины степени переворота оснований, а также конформационной динамики, происходящей во время переворота оснований. [44]
Гибридизационный зонд
Гибридизационные зонды могут использоваться для обнаружения переворота оснований. Этот метод использует молекулу, которая имеет комплементарную последовательность к последовательности, которую вы хотели бы обнаружить, так что она связывается с одной цепочкой ДНК или РНК. Несколько гибридизационных зондов использовались для обнаружения переворота оснований. Перманганат калия используется для обнаружения остатков тимина , которые были перевернуты цитозин-C5 и аденин-N6 метилтрансферазами . [45] Хлороацетальдегид используется для обнаружения остатков цитозина , перевернутых ДНК-цитозин-5 метилтрансферазой HhaI (M. HhaI). [46]

Смотрите также
- восстановление ДНК
- Базовая эксцизионная репарация
- репликация ДНК
- РНК-транскрипция
- метилирование ДНК
- ДНК-метилтрансфераза
- Генетическая рекомбинация
- Гомологичная рекомбинация
- ДНК
- Эпигенетика
- Эпигеномика
Ссылки
- ^ Робертс, Р. Дж.; Ченг, X (1998). «Переворот основания». Annual Review of Biochemistry . 67 (1): 181–198. doi :10.1146/annurev.biochem.67.1.181. PMID 9759487.
- ^ Рейтер, NJ; Блад, H; Абильдгаард, F; Бутчер, SE (2004). «Динамика внутримолекулярной петлевой петли РНК U6: конформационное изменение с переворотом основания». Биохимия . 43 (43): 13739–47. doi :10.1021/bi048815y. PMID 15504036. S2CID 25391616.
- ^ abcde Климасаускас, Саулиус; Кумар, Санджай; Робертс, Ричард Дж.; Ченг, Сяодун (январь 1994 г.). «Hhal метилтрансфераза выводит свое целевое основание из спирали ДНК». Cell . 76 (2): 357–369. doi :10.1016/0092-8674(94)90342-5. PMID 8293469. S2CID 23161543.
- ^ ab Brown, Tom. "Nucleic Acids Book". ATDBio . Получено 26 февраля 2014 г.
- ^ abcde Хуан, Ню; Нилеш К. Банавали; Александр Д. Маккерелл (7 января 2003 г.). "Переключение оснований в ДНК с помощью цитозин-5-метилтрансферазы, обеспечиваемое белком". PNAS . 100 (1): 68–73. Bibcode :2003PNAS..100...68H. doi : 10.1073/pnas.0135427100 . PMC 140885 . PMID 12506195.
- ^ ab Grubmüller, Helmut. "DNA Base Flipping". Архивировано из оригинала 4 февраля 2017 г. Получено 26 февраля 2014 г.
- ^ Бувье, Бенджамин; Грубмюллер, Хельмут (август 2007 г.). «Исследование молекулярной динамики медленного переворачивания оснований в ДНК с использованием конформационного затопления» (PDF) . Biophysical Journal . 93 (3): 770–786. Bibcode :2007BpJ....93..770B. doi :10.1529/biophysj.106.091751. PMC 1913169 . PMID 17496048. Архивировано из оригинала (PDF) 2017-08-09 . Получено 2014-03-15 .
- ^ abc Lariviere, L. (23 июня 2004 г.). «Структурное доказательство пассивного механизма переключения оснований для глюкозилтрансферазы». Журнал биологической химии . 279 (33): 34715–34720. doi : 10.1074/jbc.M404394200 . PMID 15178685.
- ^ Grosjean, [редактор] Henri (2009). Ферменты модификации ДНК и РНК: структура, механизм, функция и эволюция. Остин, Техас: Landes Bioscience. ISBN 978-1-58706-329-9. Архивировано из оригинала 2014-04-07 . Получено 2014-03-10 .
{{cite book}}:|first=имеет общее название ( помощь ) - ^ ab Huang, N.; Banavali, NK; MacKerell, AD (27 декабря 2002 г.). «Переключение оснований в ДНК с помощью цитозин-5-метилтрансферазы, обеспечиваемое белком». Труды Национальной академии наук . 100 (1): 68–73. doi : 10.1073/pnas.0135427100 . PMC 140885. PMID 12506195 .
- ^ Giudice, E. (1 марта 2003 г.). «Открытие пар оснований в B-ДНК: пути свободной энергии для пар GC и AT из моделирования выборки зонтика». Nucleic Acids Research . 31 (5): 1434–1443. doi :10.1093/nar/gkg239. PMC 149832 . PMID 12595551.
- ^ Хуан, Н.; Банавали, Н.К.; Маккерелл, А.Д. (27 декабря 2002 г.). «Переключение оснований в ДНК с помощью цитозин-5-метилтрансферазы, обеспечиваемое белком». Труды Национальной академии наук . 100 (1): 68–73. doi : 10.1073/pnas.0135427100 . PMC 140885. PMID 12506195 .
- ^ О'Нил, Лорен. Перестановка оснований в ДНК: обнаружение, структуры и энергетика, диссертация. ISBN 9780549590743. Получено 15 марта 2014 г.[ постоянная мертвая ссылка ]
- ^ Бишероур, Жюльен; Чалмерс, Рональд; Белински, Аня-Катрин (10 июля 2009 г.). «Переворот основания в транспозиции Tn10: активный механизм переворота и захвата». PLOS ONE . 4 (7): e6201. Bibcode : 2009PLoSO ...4.6201B. doi : 10.1371/journal.pone.0006201 . PMC 2705183. PMID 19593448.
- ^ Университет abcde , Джеймс Д. Уотсон, Лаборатория Колд Спринг Харбор, Таня А. Бейкер, Массачусетский технологический институт, Александр Ганн, Лаборатория Колд Спринг Харбор, Майкл Левин, Калифорнийский университет, Беркли, Ричард Лосик, Гарвард (2014). Молекулярная биология гена (Седьмое изд.). Бостон: Pearson/CSH Press. ISBN 978-0-321-76243-6.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Крокан, Ганс Э; Драблёс, Финн; Слупфауг, Гейр (16 декабря 2002 г.). «Урацил в ДНК – возникновение, последствия и восстановление». Онкоген . 21 (58): 8935–8948. дои : 10.1038/sj.onc.1205996. ПМИД 12483510.
- ^ Банерджи, Анирбан; Янг, Вэй; Карплус, Мартин; Вердин, Грегори Л. (31 марта 2005 г.). «Структура фермента репарации, исследующего неповрежденную ДНК, объясняет распознавание поврежденной ДНК». Nature . 434 (7033): 612–618. Bibcode :2005Natur.434..612B. doi :10.1038/nature03458. PMID 15800616. S2CID 4426014.
- ^ Фуксрайтер, Моника; Луо, Нинг; Едловски, Пал; Саймон, Иштван; Осман, Роман (ноябрь 2002 г.). «Роль переворота оснований в специфическом распознавании поврежденной ДНК ферментами репарации». Журнал молекулярной биологии . 323 (5): 823–834. doi :10.1016/S0022-2836(02)00999-3. PMID 12417196.
- ^ Patel, Premal H.; Suzuki, Motoshi; Adman, Elinor; Shinkai, Akeo; Loeb, Lawrence A. (май 2001 г.). «Прокариотическая ДНК-полимераза I: эволюция, структура и механизм «переворачивания основания» для выбора нуклеотидов». Журнал молекулярной биологии . 308 (5): 823–837. doi :10.1006/jmbi.2001.4619. PMID 11352575. S2CID 16277925.
- ^ Lim, HM; Lee, HJ; Roy, S.; Adhya, S. (4 декабря 2001 г.). «"Мастер" в распаривании оснований во время изомеризации промотора при связывании РНК-полимеразы». Труды Национальной академии наук . 98 (26): 14849–14852. Bibcode : 2001PNAS...9814849L. doi : 10.1073 /pnas.261517398 . PMC 64947. PMID 11734629.
- ^ Волошин, Олег Н.; Камерини-Отеро, Р. Даниэль (сентябрь 2004 г.). «Повторный взгляд на синаптический комплекс». Molecular Cell . 15 (6): 846–847. doi : 10.1016/j.molcel.2004.09.010 . PMID 15383274.
- ^ Folta-Stogniew, E; O'Malley, S; Gupta, R; Anderson, KS; Radding, CM (24 сентября 2004 г.). «Обмен парами оснований ДНК, совпадающий с распознаванием гомологии, стимулируемым белком RecA E. coli». Molecular Cell . 15 (6): 965–75. doi : 10.1016/j.molcel.2004.08.017 . PMID 15383285.
- ^ Bischerour, J.; Lu, C.; Roth, DB; Chalmers, R. (31 августа 2009 г.). «Переворот оснований в рекомбинации V(D)J: понимание механизма формирования шпилек, правила 12/23 и координации разрывов двухцепочечных ДНК». Молекулярная и клеточная биология . 29 (21): 5889–5899. doi :10.1128/MCB.00187-09. PMC 2772739. PMID 19720743 .
- ^ Клозе, Роберт Дж.; Адриан П. Берд (2006). «Геномное метилирование ДНК: метка и ее медиаторы». Тенденции в биохимических науках . 31 (2): 89–97. doi :10.1016/j.tibs.2005.12.008. ISSN 0968-0004. PMID 16403636.
- ^ Накао, М (2001). «Эпигенетика: взаимодействие метилирования ДНК и хроматина». Gene . 278 (1–2): 25–31. doi :10.1016/s0378-1119(01)00721-1. PMID 11707319.
- ^ Пласс, К.; Солоуэй, П.Д. (2002). «Метилирование ДНК, импринтинг и рак». Eur J Hum Genet . 10 (1): 6–16. doi : 10.1038/sj.ejhg.5200768 . PMID 11896451.
- ^ Эстеллер, М.; Герман, Дж. Г. (2002). «Рак как эпигенетическое заболевание: метилирование ДНК и изменения хроматина в опухолях человека». J Pathol . 196 (1): 1–7. doi :10.1002/path.1024. PMID 11748635. S2CID 35380651.
- ^ "Биология и активность эндонуклеаз рестрикции". Архивировано из оригинала 2014-04-18 . Получено 2014-04-03 .
- ^ Хортон, Джон Р.; Чжан, Син; Маунус, Роберт; Ян, Чжэ; Уилсон, Джеффри; Робертс, Ричард; Чэн, Сяодун (2006). «Никование ДНК эндонуклеазой HinP1I: изгиб, переворачивание оснований и расширение малой бороздки». Nucleic Acids Research . 34 (3): 939–948. doi : 10.1093/nar/gkj484. PMC 1363774. PMID 16473850.
- ^ Рентгеновская кристаллография
- ^ Кумар, С.; Ченг, Х.; Пфлуграт, Дж. В.; Робертс, Р. Дж. (1992). «Очистка, кристаллизация и предварительный рентгеноструктурный анализ комплекса M.HhaI-AdoMet». Биохимия . 31 (36): 8648–8653. doi :10.1021/bi00151a035. PMID 1390649.
- ^ ab Cheng, X; Kumar, S; Posfai, J; Pflugrath, JW; Roberts, RJ (1993). «Кристаллическая структура ДНК-метилтрансферазы HhaI в комплексе с S-аденозил-L-метионином». Cell . 74 (2): 299–307. doi :10.1016/0092-8674(93)90421-l. PMID 8343957. S2CID 54238106.
- ^ Brunger AT (1992) "X-PLOR, версия 3.1: система для рентгеновской кристаллографии и ЯМР" (Нью-Хейвен, Коннектикут: Издательство Йельского университета)
- ^ Фицджеральд, PMD (1988). «MERLOT, интегральный пакет компьютерных программ для определения кристаллической структуры путем молекулярного замещения». J. Appl. Crystallogr . 21 (3): 273–288. doi :10.1107/s0021889887012299.
- ^ ЯМР-спектроскопия
- ^ Gueron, M., и JL Leroy. 1995. Исследования кинетики пар оснований с помощью ЯМР-измерений протонного обмена. В Nuclear Magnetic Resonance And Nucleic Acids. Academic Press, San Diego, CA.
- ^ Лейон, М.; Граслунд, А. (1992). «Влияние последовательности и длины на обмен имино-протонами и кинетику открытия пар оснований в дуплексах ДНК-олигонуклеотидов». Nucleic Acids Res . 20 (20): 5339–5343. doi :10.1093/nar/20.20.5339. PMC 334339. PMID 1331987 .
- ^ Климасаукас, Салиус и Зита Люткевичюте. «Экспериментальные подходы к изучению переворачивания оснований ДНК». Ферменты модификации ДНК и РНК: структура, механизм, функция и эволюция. Landes Bioscience, 2009. 37–50. Веб. 16 марта 2014 г. <https://www.landesbioscience.com/pdf/04GrosjeanKlimasauskas.pdf Архивировано 07.04.2014 в Wayback Machine >.
- ^ Grosjean, [редактор] Henri (2009). Ферменты модификации ДНК и РНК: структура, механизм, функция и эволюция (PDF) . Остин, Техас: Landes Bioscience. стр. 43. ISBN 978-1-58706-329-9.
{{cite book}}:|first=имеет общее название ( помощь ) - ^ Хольц, Б. (15 февраля 1998 г.). «2-Аминопурин как флуоресцентный зонд для переворота оснований ДНК метилтрансферазами». Nucleic Acids Research . 26 (4): 1076–1083. doi :10.1093/nar/26.4.1076. PMC 147370. PMID 9461471 .
- ^ Yang, K; Matsika, S; Stanley, RJ (6 сентября 2007 г.). «6MAP, флуоресцентный аналог аденина, является зондом переворота оснований ДНК-фотолиазой». The Journal of Physical Chemistry B . 111 (35): 10615–25. doi :10.1021/jp071035p. PMID 17696385. S2CID 4998287.
- ^ Янг, К; Стэнли, Р. Дж. (май–июнь 2008 г.). «Степень деформации ДНК в комплексах ДНК-фотолиаза-субстрат: исследование флуоресценции в растворе». Фотохимия и фотобиология . 84 (3): 741–9. doi :10.1111/j.1751-1097.2007.00251.x. PMID 18086248. S2CID 44506405.
- ^ Берри, Дэвид А.; Юнг, Ки-Йонг; Вайс, Дин С.; Серсел, Энтони Д.; Пирсон, Уильям Х.; Маки, Хью; Рэндольф, Джон Б.; Сомерс, Роберт Л. (март 2004 г.). «Пирроло-dC и пирроло-C: флуоресцентные аналоги цитидина и 2′-дезоксицитидина для изучения олигонуклеотидов». Tetrahedron Letters . 45 (11): 2457–2461. doi :10.1016/j.tetlet.2004.01.108.
- ^ Нили, РК; Тамулайтис, Г.; Чен, К.; Кубала, М.; Сикснис, В.; Джонс, А.С. (8 сентября 2009 г.). «Исследования флуоресценции с временным разрешением переворота нуклеотидов ферментами рестрикции». Nucleic Acids Research . 37 (20): 6859–6870. doi :10.1093/nar/gkp688. PMC 2777440 . PMID 19740769.
- ^ Serva, S (1 августа 1998 г.). «Химическое отображение остатков тимина, выведенных наружу ДНК-метилтрансферазами». Nucleic Acids Research . 26 (15): 3473–3479. doi :10.1093/nar/26.15.3473. PMC 147733. PMID 9671807 .
- ^ Дауйотите, Д.; Люткевичюте, З.; Тамулайтис, Г.; Климасаускас, С. (15 апреля 2008 г.). «Химическое картирование цитозинов, ферментативно вывернутых из спирали ДНК». Nucleic Acids Research . 36 (10): e57. doi :10.1093/nar/gkn200. PMC 2425465. PMID 18450817 .