Тример (химия)
В химии тример ( / ˈ t r aɪ m ər / ; от древнегреческого tri- 'три' и -mer ' часть') представляет собой молекулу или многоатомный анион, образованный путем объединения или ассоциации трех молекул или ионов одного и того же вещества. На техническом жаргоне тример представляет собой разновидность олигомера, полученного из трех идентичных предшественников, часто конкурирующих с полимеризацией .
Примеры
Тримеризация алкинов

В 1866 году Марселен Бертело сообщил о первом примере циклотримеризации , превращения ацетилена в бензол . [1] Этот процесс был коммерциализирован:
Тримеризация нитрила
Симметричные 1,3,5-триазины получают путем тримеризации некоторых нитрилов, таких как хлорциан .
Хлорид цианогена и бромистый цианоген тримеризуются при повышенных температурах над углеродным катализатором. [1] Хлорид дает цианурхлорид :
Бромид имеет длительный срок хранения при охлаждении. Как и хлорид, он подвергается экзотермической тримеризации с образованием цианурбромида . Эта реакция катализируется следами брома, солей металлов, кислот и оснований. [2] По этой причине экспериментаторы избегают коричневатых образцов. [3]
Промышленный путь получения циануровой кислоты включает термическое разложение мочевины с выделением аммиака . Преобразование начинается примерно при 175 °C: [4]
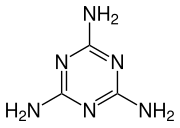
Эндотермический синтез меламина можно разделить на два этапа.
Сначала мочевина разлагается на циановую кислоту и аммиак в ходе эндотермической реакции:
Затем на втором этапе циановая кислота полимеризуется с образованием циануровой кислоты, которая конденсируется с аммиаком, выделившимся на первом этапе, с выделением меламина и воды.
Затем эта вода вступает в реакцию с присутствующей циановой кислотой, что способствует протеканию реакции тримеризации, в результате которой образуются углекислый газ и аммиак.
В целом, вторая стадия является экзотермической :
но в целом процесс эндотермический .
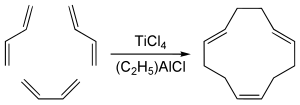
Тримеризация диенов
1,5,9-транс-транс-цис-изомер циклододекатриена , имеющий некоторое промышленное значение, получают циклотримеризацией бутадиена с тетрахлоридом титана и алюмоорганическим сокатализатором : [5]
Разрыв двойных связей углерод-гетеро образует симметричные насыщенные 1,3,5-гетероциклы
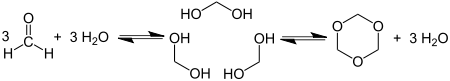
Циклотримеризация формальдегида дает 1,3,5-триоксан :
1,3,5-Тритиан является циклическим тримером в противном случае нестабильного вида тиоформальдегида . Этот гетероцикл состоит из шестичленного кольца с чередующимися метиленовыми мостиками и тиоэфирными группами. Он получается путем обработки формальдегида сероводородом . [6]
Три молекулы ацетальдегида конденсируются, образуя паральдегид — циклический тример, содержащий одинарные связи CO.
Катализируемая и дегидратируемая серной кислотой , тримеризация ацетона через альдольную конденсацию дает мезитилен [7]
Трисилоксаны
Диметилсиландиол дегидратируется до тримера Me 2 SiO , а также полидиметилсилоксана . Реакция иллюстрирует конкуренцию между тримеризацией и полимеризацией. Полимер и тример формально получены из гипотетического силакетона Me 2 Si=O , хотя этот вид не является промежуточным.
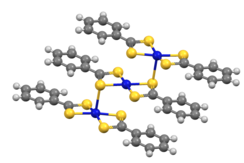
Координационная химия
Дитиобензоатные комплексы [M(S 2 CPh) 2 ] кристаллизуются в виде тримеров (M = Ni, Pd). [ 8]
Смотрите также
Ссылки
- ^ аб Хиллис О. Фолкинс (2005). "Бензол". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a03_475. ISBN 3527306730.
- ^ Моррис, Джоэл; Ковач, Лайош; Охе, Коичи (2015). «Бромистый циан». Энциклопедия реагентов для органического синтеза . С. 1– 8. doi :10.1002/047084289X.rc269.pub3. ISBN 9780470842898.
- ^ Джоэл Моррис; Лайош Ковач (2008). "Бромистый циан". Энциклопедия реагентов для органического синтеза . doi :10.1002/047084289X.rc269.pub2. ISBN 978-0471936237.
- ^ Клаус Хутмахер, Дитер Мост «Циануровая кислота и цианурхлорид» Энциклопедия промышленной химии Ульмана 2005, Wiley-VCH, Вайнхайм. doi 10.1002/14356007.a08 191
- ^ Промышленная органическая химия , Клаус Вайссермель, Ханс-Юрген Арпе, Джон Вили и сыновья; 3-й ISBN 1997 г. 3-527-28838-4
- ^ Bost, RW; Constable, EW "sym-Trithiane" Organic Syntheses, Collected Volume 2, p.610 (1943). "Архивная копия" (PDF) . Архивировано из оригинала (PDF) 2012-03-29 . Получено 2014-05-05 .
{{cite web}}: CS1 maint: archived copy as title (link) - ^ Камминг, В. М. (1937). Систематическая органическая химия (3E). Нью-Йорк, США: D. Van Nostrand Company. стр. 57.
- ^ Bonamico, M.; Dessy, G.; Fares, V.; Scaramuzza, L. (1975). «Структурные исследования комплексов металлов с серосодержащими бидентатными лигандами. Часть I. Кристаллические и молекулярные структуры тримерного бис-(дитиобензоато)-никеля(II) и -палладия(II)». Журнал химического общества, Dalton Transactions (21): 2250– 2255. doi :10.1039/DT9750002250.



![{\displaystyle {\ce {3 H2N-CO-NH2 -> [C(O)NH]3 + 3 NH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6de156d81639cf3dcee9ba7233f13135ba2bfa91)

![{\displaystyle {\ce {3 HOCN -> [C(O)NH]3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6a34f3b03c3ba201baf55fca465c07bf72526c7)
![{\displaystyle {\ce {[C(O)NH]3 + 3 NH3 -> C3H6N6 + 3 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/622a370fe2c00b97f4012e0e3294ddc0741bcc0f)