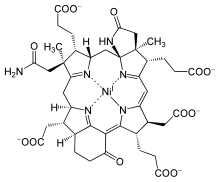
Кофактор F430
 | |
| Идентификаторы | |
|---|---|
3D модель ( JSmol ) |
|
| ХЭБИ | |
| ChemSpider | |
CID PubChem |
|
| |
| |
| Характеристики | |
| С 42ЧАС 51Н 6NiO− 13 | |
| Молярная масса | 906.58014 |
| Появление | Желтое твердое вещество |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
F 430 является кофактором (иногда называемым коферментом) фермента метилкофермента М-редуктазы (MCR). [1] [2] MCR катализирует реакцию EC 2.8.4.1, которая высвобождает метан на заключительном этапе метаногенеза :
 |  |
Он обнаружен только в метаногенных археях [3] и анаэробных метанотрофных археях. Он встречается в относительно высоких концентрациях в археях, которые участвуют в обратном метаногенезе: они могут содержать до 7% по весу белка никеля. [4]
Структура
Тривиальное название кофактор F 430 было присвоено в 1978 году на основе свойств желтого образца, извлеченного из Methanobacterium thermoautotrophicum , который имел спектроскопический максимум при 430 нм. [5] Он был идентифицирован как кофактор MCR в 1982 году [6] , а полная структура была выведена с помощью рентгеновской кристаллографии и ЯМР-спектроскопии . [7] Кофермент F 430 представляет собой восстановленный порфирин в макроциклической кольцевой системе, называемой корфином. [8] Кроме того, он обладает двумя дополнительными кольцами по сравнению со стандартным тетрапирролом (кольцами AD), имеющим γ-лактамное кольцо E и кетосодержащее карбоциклическое кольцо F. Это единственный природный тетрапиррол, содержащий никель , элемент, редко встречающийся в биологических системах. [9]
Биосинтез
 |  |  |
Биосинтез строится из уропорфириногена III , предшественника всех природных тетрапирролов, включая хлорофилл, витамин B12 , фикобилины, сирогем, гем и гем d1 . Он преобразуется в сирогидрохлорин через дигидросирогидрохлорин . [10] Вставка никеля в этот тетрапиррол катализируется в реакции EC 4.99.1.11 той же хелатазой , CbiX , которая вставляет кобальт в биосинтез кобаламина , здесь давая никель(II)-сирогидрохлорин. [11 ]
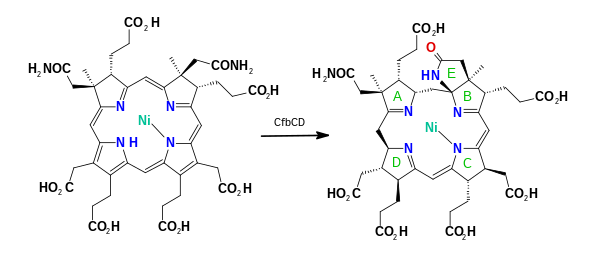
Затем АТФ-зависимая Ni-сирогидрохлорин a,c-диамидсинтаза (CfbE) преобразует боковые цепи ацетата a и c в ацетамид в реакциях EC 6.3.5.12, генерируя никель(II)-сирогидрохлорин a , c -диамид. Последовательность двух амидирований случайна. [11] Двухкомпонентный комплекс Ni-сирогидрохлорин a,c-диамид восстановительная циклаза (CfbCD) осуществляет 6-электронное и 7-протонное восстановление кольцевой системы в реакции EC 6.3.3.7, генерируя промежуточный продукт 15,17 3 - seco -F 430 -17 3 -кислоту ( seco -F 430 ). Восстановление включает гидролиз АТФ, а электроны передаются через два центра 4Fe-4S. На последнем этапе кетосодержащее карбоциклическое кольцо F образуется АТФ-зависимым ферментом коферментом F(430) синтетазой (CfbB) в реакции EC 6.4.1.9, генерируя кофермент F 430. [ 11] [12] [13] Этот фермент представляет собой MurF-подобную лигазу , которая обнаруживается в биосинтезе пептидогликана .
Ссылки
- ^ Стивен В., Рэгдейл (2014). «Биохимия метил-коэнзим М-редуктазы: никелевый металлофермент, катализирующий конечный этап синтеза и первый этап анаэробного окисления парникового газа метана». В Питере М. Х. Кронеке и Марте Э. Сосе Торрес (ред.). Биогеохимия газообразных соединений в окружающей среде, управляемая металлами . Ионы металлов в науках о жизни. Т. 14. Springer. С. 125–145. doi :10.1007/978-94-017-9269-1_6. ISBN 978-94-017-9268-4. PMID 25416393.
- ^ Хофер, Урсула (2016). «Хозяева метана». Nature Reviews Microbiology . 14 (12): 727. doi : 10.1038/nrmicro.2016.170 . PMID 27818502. S2CID 35175663.
- ^ Thauer RK (1998). «Биохимия метаногенеза: дань уважения Марджори Стивенсон». Микробиология . 144 (9): 2377–2406. doi : 10.1099/00221287-144-9-2377 . PMID 9782487.
- ^ Krüger M, Meyerdierks A, Glöckner FO, et al. (декабрь 2003 г.). «Заметный никелевый белок в микробных матах, которые анаэробно окисляют метан». Nature . 426 (6968): 878–81. Bibcode :2003Natur.426..878K. doi :10.1038/nature02207. PMID 14685246. S2CID 4383740.
- ^ Gunsalus, RP; Wolfe, RS (1978). «Хромофорные факторы F342 и F430 Methanobacterium thermoautotrophicum». FEMS Microbiology Letters . 3 (4): 191–193. doi : 10.1111/j.1574-6968.1978.tb01916.x .
- ^ Эллефсон, В. Л.; Уитман, В. Б.; Вольф, Р. С. (1982). «Фактор F430, содержащий никель: хромофор метилредуктазы метанобактерий». Труды Национальной академии наук . 79 (12): 3707–3710. Bibcode : 1982PNAS...79.3707E. doi : 10.1073 /pnas.79.12.3707 . PMC 346495. PMID 6954513.
- ^ Färber G, Keller W, Kratky C, Jaun B, Pfaltz A, Spinner C, Kobelt A, Eschenmoser A (1991). «Коэнзим F 430 из метаногенных бактерий: полное определение конфигурации на основе рентгеновского анализа пентаметилового эфира 12,13-диепи-F430 и спектроскопии ЯМР». Helvetica Chimica Acta . 74 (4): 697–716. doi :10.1002/hlca.19910740404.
- ^ Эшенмозер, А. (1986). «Химия корфиноидов». Анналы Нью-Йоркской академии наук . 471 (1 International): 108–129. Bibcode : 1986NYASA.471..108E. doi : 10.1111/j.1749-6632.1986.tb48030.x. S2CID 83719424.
- ^ Джонсон, Майкл К.; Скотт, Роберт А. (2 октября 2017 г.). Сборка активного сайта металлопротеина . Wiley. ISBN 9781119159834.
- ^ Муха, Хельмут; Келлер, Эберхард; Вебер, Ганс; Лингенс, Франц; Трёш, Вальтер (1985-10-07). "Сирогидрохлорин, предшественник биосинтеза фактора F430 в Methanobacterium thermoautotrophicum". FEBS Letters . 190 (1): 169–171. doi : 10.1016/0014-5793(85)80451-8 .
- ^ abc Мур, Саймон Дж.; Сова, Свен Т.; Шухардт, Кристофер; Дири, Эвелин; Лоуренс, Эндрю Д.; Рамос, Хосе Васкес; Биллиг, Сьюзан; Биркемейер, Клаудия; Чиверс, Питер Т.; Говард, Марк Дж.; Ригби, Стивен Э. Дж.; Лайер, Ганхильд; Уоррен, Мартин Дж. (2017). «Выяснение биосинтеза каталитического кофермента метана F430». Nature . 543 (7643): 78–82. Bibcode :2017Natur.543...78M. doi :10.1038/nature21427. PMC 5337119 . PMID 28225763.
- ^ Чжэн, Кайюань; Нго, Фонг Д.; Оуэнс, Виктория Л.; Ян, Сюэ-Пэн; Мансурабади, Стивен О. (2016). «Биосинтетический путь кофермента F430 в метаногенных и метанотрофных археях». Science . 354 (6310): 339–342. Bibcode :2016Sci...354..339Z. doi : 10.1126/science.aag2947 . PMID 27846569.
- ^ R. Caspi (2017-01-09). "Путь: биосинтез фактора 430". База данных метаболических путей MetaCyc . Получено 27-04-2020 .
