АТФ-цитратсинтаза
| АТФ-цитратсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.3.8 | ||||||||
| Номер CAS | 9027-95-6 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Человеческая АТФ-цитратлиаза | |||||||
|---|---|---|---|---|---|---|---|
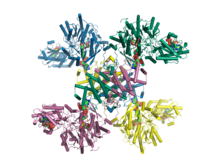 Кристаллическая структура человеческой АТФ-цитратлиазы в комплексе с цитратом, коферментом А и Mg.АДФ. [1] | |||||||
| Идентификаторы | |||||||
| Символ | АКЛИ | ||||||
| Альтернативные символы | ACL | ||||||
| ген NCBI | 47 | ||||||
| HGNC | 115 | ||||||
| ОМИМ | 108728 | ||||||
| ПДБ | 3MWE, 3PFF, 5TDE, 5TDF, 5TDM, 5TDZ, 5TE1, 5TEQ, 5TES, 5TET, 6HXH, 6HXK, 6HXL, 6HXM, 6O0H, 6QFB 3MWD, 3MWE, 3PFF, 5TDE, 5TDF, 5TDM, 5TDZ, 5TE1, 5TEQ, 5TES, 5TET, 6HXH, 6HXK, 6HXL, 6HXM, 6O0H, 6QFB | ||||||
| РефСек | NM_001096 | ||||||
| UniProt | Р53396 | ||||||
| Другие данные | |||||||
| Номер ЕС | 2.3.3.8 | ||||||
| Локус | Хр. 17 q21.2 | ||||||
| |||||||
АТФ-цитратсинтаза (также АТФ-цитратлиаза (ACLY) ) — это фермент , который у животных катализирует важный этап биосинтеза жирных кислот . [2] Превращая цитрат в ацетил-КоА , фермент связывает углеводный метаболизм , который дает цитрат в качестве промежуточного продукта , с биосинтезом жирных кислот , который потребляет ацетил-КоА. [3] В растениях АТФ-цитратлиаза генерирует цитозольные предшественники ацетил-КоА тысяч специализированных метаболитов , включая воски , стерины и поликетиды . [4]
Функция
АТФ-цитратлиаза является основным ферментом, ответственным за синтез цитозольного ацетил-КоА во многих тканях. Фермент представляет собой тетрамер , состоящий из, по-видимому, идентичных субъединиц. У животных продукт, ацетил-КоА, используется в нескольких важных биосинтетических путях, включая липогенез и холестерогенез . [5] Он активируется инсулином. [6]
В растениях АТФ-цитратлиаза генерирует ацетил-КоА для цитозольно-синтезированных метаболитов; Ацетил-КоА не транспортируется через субклеточные мембраны растений. Такие метаболиты включают: удлиненные жирные кислоты (используются в маслах семян, мембранных фосфолипидах , церамидных фрагментах сфинголипидов , кутикуле , кутине и суберине ); флавоноиды ; малоновая кислота ; ацетилированные фенолы , алкалоиды , изопреноиды , антоцианы и сахара ; и изопреноиды , полученные из мевалоната (например, сесквитерпены , стерины, брассиностероиды ); малонил- и ацил-производные (d-аминокислоты, малонилированные флавоноиды, ацилированные, пренилированные и малонированные белки). [4] Биосинтез жирных кислот de novo в растениях происходит в пластидах ; таким образом, АТФ-цитратлиаза не имеет отношения к этому пути.
Реакция
АТФ-цитратлиаза отвечает за катализ превращения цитрата и кофермента А (КоА) в ацетил-КоА и оксалоацетат , что обусловлено гидролизом АТФ . [3] В присутствии АТФ и КоА цитратлиаза катализирует расщепление цитрата с образованием ацетил-КоА, оксалоацетата , аденозиндифосфата (АДФ) и ортофосфата (P i ):
- цитрат + АТФ + КоА → оксалоацетат + ацетил-КоА + АДФ + Pi
Ранее этому ферменту был присвоен номер EC 4.1.3.8. [7]
Расположение
Фермент находится в цитозоле у растений [4] и животных. [8] [9]
Структура
Фермент состоит из двух субъединиц в зеленых растениях (включая Chlorophyceae , Marchantimorpha, Bryopsida , Pinaceae , однодольные и эвдикоты ), некоторых видах грибов , глаукофитов , хламидомонад и прокариот .
Ферменты ACL у животных являются гомомерными; слияние генов ACLA и ACLB , вероятно, произошло на ранних этапах эволюционной истории этого царства. [4]
Цитратлиаза млекопитающих АТФ имеет N-концевой цитратсвязывающий домен, который принимает складку Россмана , за которым следуют домен связывания CoA и домен CoA-лигазы, а затем домен C-концевой цитратсинтазы. Расщелина между доменами связывания CoA и цитратсинтазы образует активный сайт фермента, где связываются как цитрат, так и ацетил-кофермент А.
В 2010 году структура усеченной человеческой АТФ-цитратлиазы была определена с помощью рентгеновской дифракции с разрешением 2,10 Å . [3] В 2019 году полная структура человеческого ACLY в комплексе с субстратами коферментом А, цитратом и Mg.ADP была определена с помощью рентгеновской кристаллографии с разрешением 3,2 Å. [1] Кроме того, в 2019 году полная структура ACLY в комплексе с ингибитором была определена методами крио-ЭМ с разрешением 3,7 Å. [10] Дополнительные структуры гетеромерного ACLY-A/B из зеленых серных бактерий Chlorobium limicola и археи Methanosaeta concilii показывают, что архитектура ACLY эволюционно консервативна . [1] Полные структуры ACLY показали, что тетрамерный белок олигомеризуется через свой С-концевой домен. C-концевой домен не наблюдался в ранее определенных усеченных кристаллических структурах. C-концевая область ACLY собирается в тетрамерный модуль, который структурно похож на цитрил-КоА-лиазу (CCL), обнаруженную в глубоко ветвящихся бактериях. [1] [11] Этот модуль CCL катализирует расщепление промежуточного продукта цитрил-КоА на продукты ацетил-КоА и оксалоацетат. В 2019 году также были зарегистрированы крио-ЭМ-структуры человеческого ACLY, отдельно или связанные с субстратами или продуктами. [12] [13] ACLY образует гомотетрамер с жестким модулем гомологии цитратсинтазы (CSH), окруженным четырьмя гибкими доменами гомологии ацетил-КоА-синтетазы (ASH); CoA связан на интерфейсе CSH–ASH во взаимоисключающих продуктивных или непродуктивных конформациях. Структура каталитического мутанта ACLY в присутствии субстратов АТФ, цитрата и CoA выявляет CoA и фосфор-цитратный интермедиат в N-концевом домене. Крио-ЭМ структуры продуктов, связанных с ACLY, и субстратов, связанных с ACLY, также были определены при 3,0 Å и 3,1 Å. ЭМ структура мутанта E599Q в комплексе с CoA и фосфор-цитратным интермедиатом была определена при разрешении 2,9 Å. Сравнение этих структур апо-ACLY и лигандов, связанных с ACLY, продемонстрировало конформационные изменения в домене ASH (N-концевой домен) при связывании различных лигандов.
Фармакология
Действие фермента может быть подавлено конъюгатом кофермента А бемпедоевой кислоты , соединением, которое снижает уровень холестерина ЛПНП у людей. [14] Препарат был одобрен Управлением по контролю за продуктами и лекарствами в феврале 2020 года для использования в Соединенных Штатах.
Ссылки
- ^ abcd Вершуерен К.Х., Бланше С., Феликс Дж., Дансеркоер А., Де Вос Д., Блох Ю. и др. (апрель 2019 г.). «Структура АТФ-цитратлиазы и происхождение цитратсинтазы в цикле Кребса» (PDF) . Природа . 568 (7753): 571–575 . Бибкод : 2019Natur.568..571V. дои : 10.1038/s41586-019-1095-5. PMID 30944476. S2CID 92999924.
- ^ Elshourbagy NA, Near JC, Kmetz PJ, Wells TN, Groot PH, Saxty BA и др. (март 1992 г.). «Клонирование и экспрессия кДНК человеческой АТФ-цитратлиазы». European Journal of Biochemistry . 204 (2): 491– 9. doi : 10.1111/j.1432-1033.1992.tb16659.x . PMID 1371749.
- ^ abc Sun T, Hayakawa K, Bateman KS, Fraser ME (август 2010 г.). «Идентификация сайта связывания цитрата человеческой АТФ-цитратлиазы с использованием рентгеновской кристаллографии». Журнал биологической химии . 285 (35): 27418– 28. doi : 10.1074/jbc.M109.078667 . PMC 2930740. PMID 20558738 .
- ^ abcd Fatland BL, Ke J, Anderson MD, Mentzen WI, Cui LW, Allred CC и др. (октябрь 2002 г.). «Молекулярная характеристика гетеромерной АТФ-цитратлиазы, которая генерирует цитозольный ацетил-коэнзим A в Arabidopsis». Физиология растений . 130 (2): 740–56 . doi :10.1104/pp.008110. PMC 166603. PMID 12376641.
- ^ «Ген Энтреза: АТФ-цитратлиаза».
- ^ Guay C, Madiraju SR, Aumais A, Joly E, Prentki M (декабрь 2007 г.). «Роль АТФ-цитратлиазы, яблочного фермента и цикла пирувата/цитрата в секреции инсулина, вызванной глюкозой». Журнал биологической химии . 282 (49): 35657– 65. doi : 10.1074/jbc.M707294200 . PMID 17928289.
- ^ АТФ+цитрат+лиаза в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
- ^ Zaidi N, Swinnen JV, Smans K (2012). «АТФ-цитратлиаза: ключевой игрок в метаболизме рака». Cancer Research . 72 (15): 3709– 3714. doi : 10.1158/0008-5472.CAN-11-4112 . PMID 22787121.
- ^ Pietrocola F, Galluzzi L, Bravo-San Pedro JM, Madeo F, Kroemer G (2015). «Ацетил-коэнзим A: центральный метаболит и вторичный мессенджер». Клеточный метаболизм . 21 (6): 805–821 . doi : 10.1016/j.cmet.2015.05.014 . PMID 26039447.
- ^ Вей Дж., Лейт С., Куай Дж., Терриен Э., Рафи С., Харвуд Х.Дж. и др. (апрель 2019 г.). «Аллостерический механизм мощного ингибирования АТФ-цитратлиазы человека». Природа . 568 (7753): 566–570 . Бибкод : 2019Natur.568..566W. дои : 10.1038/s41586-019-1094-6. PMID 30944472. S2CID 93000843.
- ^ Aoshima M, Ishii M, Igarashi Y (май 2004 г.). "Новый фермент, цитрил-КоА-лиаза, катализирующий второй этап реакции расщепления цитрата в Hydrogenobacter thermophilus TK-6". Молекулярная микробиология . 52 (3): 763– 70. doi :10.1111/j.1365-2958.2004.04010.x. PMID 15101982. S2CID 32105039.
- ^ Wei X, Schultz K, Bazilevsky GA, Vogt A, Marmorstein R (январь 2020 г.). «Молекулярная основа производства ацетил-КоА АТФ-цитратлиазой». Nature Structural & Molecular Biology . 27 (1): 33– 41. doi :10.1038/s41594-019-0351-6. PMC 8436250 . PMID 31873304.
- ^ Wei X, Schultz K, Bazilevsky GA, Vogt A, Marmorstein R (май 2020 г.). «Исправление автора: Молекулярная основа для производства ацетил-КоА АТФ-цитратлиазой». Nature Structural & Molecular Biology . 27 (5): 511– 513. doi : 10.1038/s41594-020-0421-9 . PMC 8439269 . PMID 32242119.
- ^ Ray KK, Bays HE, Catapano AL, Lalwani ND, Bloedon LT, Sterling LR и др. (Исследование CLEAR Harmony) (март 2019 г.). «Безопасность и эффективность бемпедоевой кислоты для снижения уровня холестерина ЛПНП». The New England Journal of Medicine . 380 (11): 1022–1032 . doi : 10.1056/NEJMoa1803917 . hdl : 10044/1/68213 . PMID 30865796.
Дальнейшее чтение
- Lill U, Schreil A, Eggerer H (июль 1982). «Выделение ферментативно активных фрагментов, образованных ограниченным протеолизом АТФ-цитратлиазы». European Journal of Biochemistry . 125 (3): 645–50 . doi :10.1111/j.1432-1033.1982.tb06731.x. PMID 6749502.
- Srere PA, Lipmann F (1953). "Ферментативная реакция между цитратом, аденозинтрифосфатом и коферментом A". Журнал Американского химического общества . 75 (19): 4874. doi :10.1021/ja01115a547.
Внешние ссылки
- АТФ-цитратлиаза в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
В данной статье использован текст из Национальной медицинской библиотеки США , являющийся общественным достоянием .
