Круговая перестановка в белках

Круговая перестановка — это связь между белками , при которой белки имеют измененный порядок аминокислот в своей пептидной последовательности . Результатом является структура белка с другой связностью, но в целом схожей трехмерной (3D) формой. В 1979 году была открыта первая пара круговых перестановочных белков — конканавалин А и лектин ; сейчас известно более 2000 таких белков.
Круговая перестановка может происходить в результате эволюционных событий, посттрансляционных модификаций или искусственно созданных мутаций. Две основные модели, предложенные для объяснения эволюции циклически переставленных белков, — это перестановка путем дупликации и деление и слияние . Перестановка путем дупликации происходит, когда ген подвергается дупликации с образованием тандемного повтора , прежде чем избыточные участки белка удаляются; эта связь обнаружена между сапозином и свапозином. Деление и слияние происходят, когда частичные белки сливаются с образованием одного полипептида, например, в никотинамиднуклеотидтрансгидрогеназах .
Круговые перестановки обычно создаются в лабораторных условиях с целью улучшения их каталитической активности или термостабильности , а также для исследования свойств исходного белка.
Традиционные алгоритмы выравнивания последовательностей и структур не способны обнаружить циклические перестановки между белками. Были разработаны новые нелинейные подходы, которые преодолевают это и способны обнаруживать топологически -независимые сходства.
История

В 1979 году Брюс Каннингем и его коллеги обнаружили первый случай циркулярно переставленного белка в природе. [1] После определения пептидной последовательности лектинового белка фавина, они заметили его сходство с известным белком – конканавалином А – за исключением того, что концы были циркулярно переставлены. Более поздняя работа подтвердила циклическую перестановку между парой [2] и показала, что конканавалин А переставляется посттрансляционно [3] посредством расщепления и необычного лигирования белка. [4]
После открытия естественного циклически переставленного белка исследователи искали способ имитировать этот процесс. В 1983 году Дэвид Голденберг и Томас Крейтон смогли создать циклически переставленную версию белка путем химического лигирования концов для создания циклического белка , а затем введения новых концов в другом месте с помощью трипсина . [5] В 1989 году Каролин Люгер и ее коллеги представили генетический метод создания циклических перестановок путем тщательной фрагментации и лигирования ДНК. [6] Этот метод позволил вводить перестановки в произвольных местах. [6]
Несмотря на раннее открытие посттрансляционных циклических перестановок и предположение о возможном генетическом механизме развития циклических перестановок, только в 1995 году была обнаружена первая циклически переставленная пара генов. Сапозины — это класс белков, участвующих в катаболизме сфинголипидов и антигенной презентации липидов у людей. Крис Понтинг и Роберт Рассел идентифицировали циклически переставленную версию сапозина, встроенную в растительную аспарагиновую протеиназу , которую они назвали свапозином . [7] Сапозин и свапозин были первым известным случаем двух природных генов, связанных циклической перестановкой. [7]
Сотни примеров пар белков, связанных круговой перестановкой, были впоследствии обнаружены в природе или получены в лаборатории. По состоянию на февраль 2012 года база данных круговых перестановок [8] содержит 2238 пар белков с круговой перестановкой с известными структурами, и еще больше пар известно без структур. [9] База данных CyBase собирает циклические белки, некоторые из которых являются переставленными вариантами циклических белков дикого типа. [10] SISYPHUS — это база данных, которая содержит коллекцию вручную подобранных выравниваний белков с нетривиальными отношениями, некоторые из которых имеют круговые перестановки. [11]
Эволюция
В настоящее время для объяснения эволюции циклически переставленных белков используются две основные модели: перестановка путем дупликации и деление и слияние . Обе модели имеют убедительные примеры, подтверждающие их, но относительный вклад каждой модели в эволюцию все еще является предметом споров. [12] Были предложены и другие, менее распространенные механизмы, такие как «вырезать и вставить» [13] или « перетасовка экзонов ». [14]
Перестановка путем дублирования
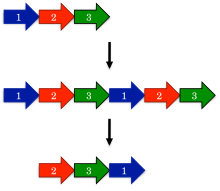
Самая ранняя модель, предложенная для эволюции кольцевых перестановок, — это механизм перестановки путем дупликации. [1] В этой модели ген-предшественник сначала подвергается дупликации и слиянию, образуя большой тандемный повтор . Затем в соответствующие места в дуплицированном гене вводятся стартовые и стоп-кодоны , удаляя избыточные участки белка.
Одно удивительное предсказание механизма перестановки путем дупликации заключается в том, что могут происходить промежуточные перестановки. Например, дублированная версия белка должна быть функциональной, поскольку в противном случае эволюция быстро отобрала бы такие белки. Аналогично, частично дублированные промежуточные продукты, где был усечен только один конец, должны быть функциональными. Такие промежуточные продукты были подробно описаны в семействах белков, таких как ДНК-метилтрансферазы . [15]
Сапозин и свапозин

Примером перестановки путем дупликации является связь между сапозином и свапозином. Сапозины являются высококонсервативными гликопротеинами , длиной приблизительно 80 аминокислотных остатков и образующими четырехальфа -спиральную структуру. Они имеют почти идентичное размещение остатков цистеина и участков гликозилирования. Последовательность кДНК , которая кодирует сапозин, называется просапозин . Он является предшественником четырех продуктов расщепления, сапозинов A, B, C и D. Четыре домена сапозина, скорее всего, возникли из двух тандемных дупликаций предкового гена. [16] Этот повтор предполагает механизм эволюции связи со специфичной для растений вставкой (PSI). PSI — это домен, встречающийся исключительно в растениях, состоящий приблизительно из 100 остатков и обнаруженный в растительных аспарагиновых протеазах . [17] Он принадлежит к семейству сапозиноподобных белков (SAPLIP) и имеет «поменянные местами» N- и C-концы, так что порядок спиралей составляет 3-4-1-2 по сравнению с сапозином, что и привело к названию «свапозин». [7] [18]
Деление и синтез

Другая модель эволюции циклических перестановок — модель деления и слияния. Процесс начинается с двух частичных белков. Они могут представлять два независимых полипептида (например, две части гетеродимера ) или изначально были половинами одного белка, который подвергся делению, чтобы стать двумя полипептидами.
Два белка могут позже слиться вместе, образуя один полипептид. Независимо от того, какой белок появился первым, этот белок слияния может демонстрировать схожую функцию. Таким образом, если слияние двух белков происходит дважды в эволюции (либо между паралогами в пределах одного вида, либо между ортологами в разных видах), но в разном порядке, полученные белки слияния будут связаны циклической перестановкой.
Доказательства того, что определенный белок эволюционировал посредством механизма деления и слияния, можно получить, наблюдая за половинами перестановки как независимыми полипептидами в родственных видах или демонстрируя экспериментально, что две половины могут функционировать как отдельные полипептиды. [19]
Трансгидрогеназы

Примером механизма деления и слияния могут служить никотинамиднуклеотидтрансгидрогеназы . [20] Это связанные с мембраной ферменты , которые катализируют перенос гидрид-иона между НАД(Н) и НАДФ(Н) в реакции, которая сопряжена с трансмембранной транслокацией протонов . Они состоят из трех основных функциональных единиц (I, II и III), которые можно обнаружить в различном расположении у бактерий , простейших и высших эукариот . Филогенетический анализ показывает, что три группы расположений доменов были приобретены и слиты независимо. [12]
Другие процессы, которые могут привести к циклическим перестановкам
Посттрансляционная модификация
Две упомянутые выше эволюционные модели описывают способы, которыми гены могут быть циклически переставлены, что приводит к циклически переставленной мРНК после транскрипции . Белки также могут быть циклически переставлены посредством посттрансляционной модификации , без перестановки лежащего в основе гена. Циклические перестановки могут происходить спонтанно посредством автокатализа , как в случае конканавалина А. [ 4] С другой стороны, для перестановки могут потребоваться ферменты рестрикции и лигазы . [5]
Роль в белковой инженерии
Многие белки имеют концы, расположенные близко друг к другу в трехмерном пространстве. [21] [22] Благодаря этому часто можно проектировать круговые перестановки белков. Сегодня круговые перестановки регулярно генерируются в лаборатории с использованием стандартных генетических методов. [6] Хотя некоторые сайты перестановок не позволяют белку правильно сворачиваться , было создано много перестановок с почти идентичной исходному белку структурой и функцией.
Мотивация создания кольцевого пермутанта белка может быть разной. Ученые могут захотеть улучшить некоторые свойства белка, например:
- Снижение протеолитической восприимчивости. Скорость, с которой белки расщепляются, может иметь большое влияние на их активность в клетках. Поскольку концы часто доступны для протеаз , разработка циклически переставленного белка с менее доступными концами может увеличить продолжительность жизни этого белка в клетке. [23]
- Улучшить каталитическую активность . Циклическая перестановка белка иногда может увеличить скорость, с которой он катализирует химическую реакцию, что приводит к более эффективным белкам. [24]
- Изменить связывание субстрата или лиганда . Циклическая перестановка белка может привести к потере связывания субстрата , но иногда может привести к новой активности связывания лиганда или измененной специфичности субстрата. [25]
- Улучшить термостабильность . Повышение активности белков в более широком диапазоне температур и условий может повысить их полезность. [26]
С другой стороны, ученых могут интересовать свойства исходного белка, такие как:
- Порядок сворачивания. Определение порядка, в котором сворачиваются различные части белка, является сложной задачей из-за чрезвычайно быстрых временных масштабов. Циклически переставленные версии белков часто сворачиваются в другом порядке, предоставляя информацию о сворачивании исходного белка. [27] [28] [29]
- Основные структурные элементы. Искусственные циклически переставленные белки могут позволить выборочно удалять части белка. Это дает представление о том, какие структурные элементы являются основными, а какие нет. [30]
- Изменить четвертичную структуру . Было показано, что циклически переставленные белки принимают иную четвертичную структуру, чем белки дикого типа. [31]
- Найдите места вставки для других белков. Вставка одного белка в качестве домена в другой белок может быть полезной. Например, вставка кальмодулина в зеленый флуоресцентный белок (GFP) позволила исследователям измерить активность кальмодулина через флуоресценцию расщепленного GFP. [32] Области GFP, которые допускают введение круговой перестановки, с большей вероятностью примут добавление другого белка, сохраняя при этом функцию обоих белков.
- Разработка новых биокатализаторов и биосенсоров. Введение круговых перестановок может быть использовано для разработки белков для катализа определенных химических реакций, [24] [33] или для обнаружения присутствия определенных молекул с использованием белков. Например, описанное выше слияние GFP-кальмодулина может быть использовано для обнаружения уровня ионов кальция в образце. [32]
Алгоритмическое обнаружение
Многие алгоритмы выравнивания последовательностей и выравнивания структур белков были разработаны с учетом линейного представления данных и, как таковые, не способны обнаруживать циклические перестановки между белками. [34] Двумя примерами часто используемых методов, которые имеют проблемы с правильным выравниванием белков, связанных циклической перестановкой, являются динамическое программирование и многие скрытые модели Маркова . [34] В качестве альтернативы им, ряд алгоритмов построены на основе нелинейных подходов и способны обнаруживать топологически -независимые сходства или использовать модификации, позволяющие им обойти ограничения динамического программирования. [34] [35] В таблице ниже представлен набор таких методов.
Алгоритмы классифицируются в соответствии с типом входных данных, которые им требуются. Алгоритмы на основе последовательностей требуют только последовательности двух белков для создания выравнивания. [36] Методы последовательностей, как правило, быстры и подходят для поиска целых геномов для циклически переставленных пар белков. [36] Методы на основе структур требуют трехмерных структур обоих рассматриваемых белков. [37] Они часто медленнее методов на основе последовательностей, но способны обнаруживать циклические перестановки между отдаленно связанными белками с низким сходством последовательностей. [37] Некоторые структурные методы являются топологически независимыми , что означает, что они также способны обнаруживать более сложные перестройки, чем циклическая перестановка. [38]
| ИМЯ | Тип | Описание | Автор | Год | Доступность | Ссылка |
|---|---|---|---|---|---|---|
| FBPLOT | Последовательность | Рисует точечные диаграммы неоптимальных выравниваний последовательностей | Цукер | 1991 | [39] | |
| Бачар и др. | Структура, топология независимы | Использует геометрическое хеширование для топологически независимого сравнения белков. | Бачар и др. | 1993 | [35] | |
| Улиель и др. | Последовательность | Первое предположение о том, как может работать алгоритм сравнения последовательностей для обнаружения циклических перестановок | Улиель и др. | 1999 | [36] | |
| ШЕБА | Структура | Использует алгоритм SHEBA для создания структурных выравниваний для различных точек перестановки, одновременно итеративно улучшая точку среза. | Юнг и Ли | 2001 | [14] | |
| Мультипрот | Структура, топология независимы | Вычисляет независимое от порядка последовательности выравнивание множественной структуры белка | Шацкий | 2004 | сервер, скачать | [38] |
| РАСПОДОМ | Последовательность | Модифицированный алгоритм сравнения последовательностей Нидлмана и Вунша | Вайнер и др. | 2005 | скачать | [34] |
| CPSARST | Структура | Описывает структуры белков как одномерные текстовые строки с использованием алгоритма последовательного преобразования Рамачандрана (RST). Обнаруживает циклические перестановки посредством дублирования представления последовательности и стратегии «двойной фильтрации и уточнения». | Ло, Лю | 2008 | сервер | [40] |
| ГАНГСТА + | Структура | Работает в два этапа: на первом этапе определяются грубые выравнивания на основе элементов вторичной структуры. На втором этапе уточняется выравнивание на уровне остатков и распространяется на области петель. | Шмидт-Геннер и др. | 2009 | сервер, скачать | [41] |
| САНА | Структура | Определить начальные выровненные пары фрагментов (AFP). Построить сеть возможных AFP. Использовать алгоритм случайного сопряжения для соединения компонентов в граф. | Ван и др. | 2010 | скачать | [42] |
| CE-CP | Структура | Создан на основе алгоритма комбинаторного расширения . Дублирует атомы перед выравниванием, обрезает результаты после выравнивания | Бливен и др. | 2015 | сервер, скачать | [43] |
| ТопМатч | Структура | Имеет возможность расчета топологически-независимого выравнивания структуры белка | Сиппл и Видерштейн | 2012 | сервер, скачать | [44] |
Ссылки
 Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 (2012) (отчеты рецензента): Spencer Bliven; Andreas Prlić (2012). "Circular permutation in proteins". PLOS Computational Biology . 8 (3): e1002445. doi : 10.1371/JOURNAL.PCBI.1002445 . ISSN 1553-734X. PMC 3320104 . PMID 22496628. Wikidata Q5121672.
Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 (2012) (отчеты рецензента): Spencer Bliven; Andreas Prlić (2012). "Circular permutation in proteins". PLOS Computational Biology . 8 (3): e1002445. doi : 10.1371/JOURNAL.PCBI.1002445 . ISSN 1553-734X. PMC 3320104 . PMID 22496628. Wikidata Q5121672.
- ^ abc Cunningham BA, Hemperly JJ, Hopp TP, Edelman GM (июль 1979). «Фавин против конканавалина A: циклически переставленные аминокислотные последовательности». Труды Национальной академии наук Соединенных Штатов Америки . 76 (7): 3218–22. Bibcode :1979PNAS...76.3218C. doi : 10.1073/pnas.76.7.3218 . PMC 383795 . PMID 16592676.
- ^ Einspahr H, Parks EH, Suguna K, Subramanian E, Suddath FL (декабрь 1986 г.). «Кристаллическая структура лектина гороха при разрешении 3,0 А». Журнал биологической химии . 261 (35): 16518–27. doi : 10.1016/S0021-9258(18)66597-4 . PMID 3782132.
- ^ Carrington DM, Auffret A, Hanke DE (1985). «Полипептидное лигирование происходит во время посттрансляционной модификации конканавалина А». Nature . 313 (5997): 64–7. Bibcode :1985Natur.313...64C. doi :10.1038/313064a0. PMID 3965973. S2CID 4359482.
- ^ ab Bowles DJ, Pappin DJ (февраль 1988). «Движение и сборка конканавалина А». Тенденции в биохимических науках . 13 (2): 60–4. doi :10.1016/0968-0004(88)90030-8. PMID 3070848.
- ^ ab Goldenberg DP, Creighton TE (апрель 1983 г.). «Круговые и циркулярно переставленные формы ингибитора трипсина поджелудочной железы быка». Журнал молекулярной биологии . 165 (2): 407–13. doi :10.1016/S0022-2836(83)80265-4. PMID 6188846.
- ^ abc Luger K, Hommel U, Herold M, Hofsteenge J, Kirschner K (январь 1989). «Правильное сворачивание циклически переставленных вариантов фермента бета-альфа-бочонка in vivo». Science . 243 (4888): 206–10. Bibcode :1989Sci...243..206L. doi :10.1126/science.2643160. PMID 2643160.
- ^ abcd Ponting CP, Russell RB (май 1995). «Свапозины: циклические перестановки внутри генов, кодирующих гомологи сапозина». Trends in Biochemical Sciences . 20 (5): 179–80. doi :10.1016/S0968-0004(00)89003-9. PMID 7610480.
- ^ Lo WC, Lee CC, Lee CY, Lyu PC. "База данных круговых перестановок". Институт биоинформатики и структурной биологии Национального университета Цинхуа . Получено 16 февраля 2012 г.
- ^ Lo WC, Lee CC, Lee CY, Lyu PC (январь 2009 г.). «CPDB: база данных циклических перестановок в белках». Nucleic Acids Research . 37 (выпуск базы данных): D328–32. doi :10.1093/nar/gkn679. PMC 2686539. PMID 18842637 .
- ^ Kaas Q, Craik DJ (2010). «Анализ и классификация кольцевых белков в CyBase». Биополимеры . 94 (5): 584–91. doi : 10.1002/bip.21424 . PMID 20564021.
- ^ Андреева А, Прлич А, Хаббард Т.Дж., Мурзин АГ (январь 2007 г.). «СИЗИФ — структурные выравнивания для белков с нетривиальными связями». Nucleic Acids Research . 35 (выпуск базы данных): D253–9. doi :10.1093/nar/gkl746. PMC 1635320. PMID 17068077 .
- ^ ab Weiner J, Bornberg-Bauer E (апрель 2006 г.). «Эволюция циклических перестановок в многодоменных белках». Молекулярная биология и эволюция . 23 (4): 734–43. doi : 10.1093/molbev/msj091 . PMID 16431849.
- ^ Bujnicki JM (март 2002 г.). «Перестановки последовательностей в молекулярной эволюции ДНК-метилтрансфераз». BMC Evolutionary Biology . 2 (1): 3. doi : 10.1186/1471-2148-2-3 . PMC 102321. PMID 11914127 .
- ^ ab Jung J, Lee B (сентябрь 2001 г.). «Циклически переставленные белки в базе данных структур белков». Protein Science . 10 (9): 1881–6. doi :10.1110/ps.05801. PMC 2253204 . PMID 11514678.
- ^ Jeltsch A (июль 1999). «Круговые перестановки в молекулярной эволюции ДНК-метилтрансфераз». Журнал молекулярной эволюции . 49 (1): 161–4. Bibcode :1999JMolE..49..161J. doi :10.1007/pl00006529. PMID 10368444. S2CID 24116226.
- ^ Hazkani-Covo E, Altman N, Horowitz M, Graur D (январь 2002 г.). «Эволюционная история просапозина: два последовательных события тандемной дупликации привели к появлению четырех доменов сапозина у позвоночных». Journal of Molecular Evolution . 54 (1): 30–4. Bibcode :2002JMolE..54...30H. doi :10.1007/s00239-001-0014-0. PMID 11734895. S2CID 7402721.
- ^ Guruprasad K, Törmäkangas K, Kervinen J, Blundell TL (сентябрь 1994 г.). "Сравнительное моделирование аспарагиновой протеиназы ячменного зерна: структурное обоснование наблюдаемой гидролитической специфичности". FEBS Letters . 352 (2): 131–6. Bibcode : 1994FEBSL.352..131G. doi : 10.1016/0014-5793(94)00935-X . PMID 7925961. S2CID 32524531.
- ^ Bruhn H (июль 2005 г.). «Краткий обзор функциональных и структурных особенностей сапозиноподобных белков». The Biochemical Journal . 389 (Pt 2): 249–57. doi :10.1042/BJ20050051. PMC 1175101. PMID 15992358.
- ^ Ли Дж., Блейбер М. (январь 2011 г.). «Экспериментальное подтверждение эволюции симметричной архитектуры белка из простого пептидного мотива». Труды Национальной академии наук Соединенных Штатов Америки . 108 (1): 126–30. Bibcode : 2011PNAS..108..126L. doi : 10.1073 /pnas.1015032108 . PMC 3017207. PMID 21173271.
- ^ ab Hatefi Y, Yamaguchi M (март 1996). "Никотинамиднуклеотидтрансгидрогеназа: модель использования энергии связывания субстрата для транслокации протона". FASEB Journal . 10 (4): 444–52. doi : 10.1096/fasebj.10.4.8647343 . PMID 8647343. S2CID 21898930.
- ^ Thornton JM, Sibanda BL (июнь 1983). «Амино- и карбоксиконцевые области в глобулярных белках». Журнал молекулярной биологии . 167 (2): 443–60. doi :10.1016/S0022-2836(83)80344-1. PMID 6864804.
- ^ Yu Y, Lutz S (январь 2011 г.). «Круговая перестановка: другой способ проектирования структуры и функции фермента». Тенденции в биотехнологии . 29 (1): 18–25. doi :10.1016/j.tibtech.2010.10.004. PMID 21087800.
- ^ Whitehead TA, Bergeron LM, Clark DS (октябрь 2009 г.). «Связывание свободных концов: циклическая перестановка снижает протеолитическую восприимчивость рекомбинантных белков». Protein Engineering, Design & Selection . 22 (10): 607–13. doi : 10.1093/protein/gzp034 . PMID 19622546.
- ^ ab Cheltsov AV, Barber MJ, Ferreira GC (июнь 2001 г.). «Круговая перестановка 5-аминолевулинатсинтазы. Сопоставление полипептидной цепи с ее функцией». Журнал биологической химии . 276 (22): 19141–9. doi : 10.1074/jbc.M100329200 . PMC 4547487. PMID 11279050 .
- ^ Qian Z, Lutz S (октябрь 2005 г.). «Улучшение каталитической активности липазы B Candida antarctica путем круговой перестановки». Журнал Американского химического общества . 127 (39): 13466–7. doi :10.1021/ja053932h. PMID 16190688.(основной источник)
- ^ Topell S, Hennecke J, Glockshuber R (август 1999). "Circularly permuted variations of the green fluorescent protein". FEBS Letters . 457 (2): 283–9. Bibcode : 1999FEBSL.457..283T. doi : 10.1016/S0014-5793(99)01044-3. PMID 10471794. S2CID 43085373.(основной источник)
- ^ Viguera AR, Serrano L, Wilmanns M (октябрь 1996 г.). «Различные переходные состояния сворачивания могут приводить к одной и той же нативной структуре». Nature Structural Biology . 3 (10): 874–80. doi :10.1038/nsb1096-874. PMID 8836105. S2CID 11542397.(основной источник)
- ^ Capraro DT, Roy M, Onuchic JN, Jennings PA (сентябрь 2008 г.). «Обратное отслеживание ландшафта складывания белка бета-трилистника интерлейкин-1бета?». Труды Национальной академии наук Соединенных Штатов Америки . 105 (39): 14844–8. Bibcode : 2008PNAS..10514844C. doi : 10.1073/pnas.0807812105 . PMC 2567455. PMID 18806223 .
- ^ Zhang P, Schachman HK (июль 1996 г.). «In vivo образование аллостерической аспартаттранскарбамоилазы, содержащей циклически переставленные каталитические полипептидные цепи: последствия для сворачивания и сборки белка». Protein Science . 5 (7): 1290–300. doi :10.1002/pro.5560050708. PMC 2143468 . PMID 8819162. (основной источник)
- ^ Хуан YM, Наяк S, Быстрофф C (ноябрь 2011 г.). «Количественная растворимость in vivo и восстановление усеченных кольцевых пермутантов зеленого флуоресцентного белка». Protein Science . 20 (11): 1775–80. doi :10.1002/pro.735. PMC 3267941 . PMID 21910151. (основной источник)
- ^ Beernink PT, Yang YR, Graf R, King DS, Shah SS, Schachman HK (март 2001 г.). «Случайная круговая перестановка, приводящая к разрыву цепи внутри и около альфа-спиралей в каталитических цепях аспартаттранскарбамоилазы: влияние на сборку, стабильность и функцию». Protein Science . 10 (3): 528–37. doi :10.1110/ps.39001. PMC 2374132 . PMID 11344321.
- ^ ab Baird GS, Zacharias DA, Tsien RY (сентябрь 1999 г.). «Круговая перестановка и вставка рецепторов в зеленые флуоресцентные белки». Труды Национальной академии наук Соединенных Штатов Америки . 96 (20): 11241–6. Bibcode : 1999PNAS...9611241B. doi : 10.1073 /pnas.96.20.11241 . PMC 18018. PMID 10500161.
- ^ Turner NJ (август 2009). «Направленная эволюция движет следующим поколением биокатализаторов». Nature Chemical Biology . 5 (8): 567–73. doi :10.1038/nchembio.203. PMID 19620998.
- ^ abcd Weiner J, Thomas G, Bornberg-Bauer E (апрель 2005 г.). «Быстрое предсказание циклических перестановок в многодоменных белках на основе мотивов». Биоинформатика . 21 (7): 932–7. doi : 10.1093/bioinformatics/bti085 . PMID 15788783.
- ^ ab Bachar O, Fischer D, Nussinov R, Wolfson H (апрель 1993 г.). «Технология компьютерного зрения для трехмерного структурного сравнения белков, независимого от последовательности». Protein Engineering . 6 (3): 279–88. doi :10.1093/protein/6.3.279. PMID 8506262.
- ^ abc Uliel S, Fliess A, Amir A, Unger R (ноябрь 1999). "Простой алгоритм обнаружения циклических перестановок в белках". Биоинформатика . 15 (11): 930–6. doi : 10.1093/bioinformatics/15.11.930 . PMID 10743559.
- ^ ab Prlic A, Bliven S, Rose PW, Bluhm WF, Bizon C, Godzik A, Bourne PE (декабрь 2010 г.). «Предварительно рассчитанные выравнивания структур белков на веб-сайте RCSB PDB». Биоинформатика . 26 (23): 2983–5. doi :10.1093/bioinformatics/btq572. PMC 3003546. PMID 20937596 .
- ^ ab Shatsky M, Nussinov R, Wolfson HJ (июль 2004 г.). «Метод одновременного выравнивания множественных белковых структур». Proteins . 56 (1): 143–56. doi :10.1002/prot.10628. PMID 15162494. S2CID 14665486.
- ^ Zuker M (сентябрь 1991 г.). «Субоптимальное выравнивание последовательностей в молекулярной биологии. Выравнивание с анализом ошибок». Журнал молекулярной биологии . 221 (2): 403–20. doi :10.1016/0022-2836(91)80062-Y. PMID 1920426.
- ^ Lo WC, Lyu PC (январь 2008 г.). "CPSARST: эффективный инструмент поиска циклических перестановок, применяемый для обнаружения новых структурных связей белков". Genome Biology . 9 (1): R11. doi : 10.1186/gb-2008-9-1-r11 . PMC 2395249 . PMID 18201387.
- ^ Schmidt-Goenner T, Guerler A, Kolbeck B, Knapp EW (май 2010). «Циклические переставленные белки во вселенной белковых складок». Proteins . 78 (7): 1618–30. doi :10.1002/prot.22678. PMID 20112421. S2CID 20673981.
- ^ Wang L, Wu LY, Wang Y, Zhang XS, Chen L (июль 2010 г.). «SANA: алгоритм последовательного и непоследовательного выравнивания структуры белка». Аминокислоты . 39 (2): 417–25. doi :10.1007/s00726-009-0457-y. PMID 20127263. S2CID 2292831.
- ^ Bliven SE, Bourne PE, Prlić A (апрель 2015 г.). «Обнаружение циклических перестановок в белковых структурах с использованием CE-CP». Биоинформатика . 31 (8): 1316–8. doi :10.1093/bioinformatics/btu823. PMC 4393524. PMID 25505094 .
- ^ Sippl MJ, Wiederstein M (апрель 2012 г.). «Обнаружение пространственных корреляций в белковых структурах и молекулярных комплексах». Structure . 20 (4): 718–28. doi :10.1016/j.str.2012.01.024. PMC 3320710 . PMID 22483118.
Дальнейшее чтение
- Дэвид Гудселл (апрель 2010 г.) Конканавалин А и банк данных кольцевых пермутационных белков (PDB) Молекула месяца