Циннамицин
 | |
| Имена | |
|---|---|
| Название ИЮПАК (1 S ,4 S ,13 S ,16 S ,19 R ,22 S ,25 S ,28 R ,31 S ,37 S ,41 R ,44 R ,47 S ,50 S ,53 R ,56 R ,65 S )-44-амино-37-(2-амино-2-оксоэтил)-50-(3-амино-3-оксопропил)-4,16,22-трибензил-47-(3-карбамимидамидопропил)-31-[( R )-карбокси(гидрокси)метил]-41,70-диметил-2,5,8,14,17,20,23,26,29,32,35,38,45,48,51,54,57,67-октадекаоксо-25-пропан-2-ил-42,69,72-тритиа-3,6,9,15,18,21,24,27,30,33,36,39,46,49,52,55,58,60,66-нонадеказапентацикло[38.18.9.3 19,56 .3 28,53 .0 9,13 ]тригептаконтан-65-карбоновая кислота | |
| Другие имена Лантиопептин; NSC-71936; Ro09-198 | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ |
|
| ChemSpider |
|
CID PubChem |
|
| УНИИ | |
| |
| |
| Характеристики | |
| С 89 Н 125 Н 25 О 25 С 3 | |
| Молярная масса | 2 041 .31 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
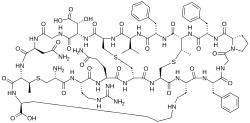
Циннамицин — это тетрациклический антибактериальный пептид, продуцируемый Streptomyces cinnamoneus, содержащий 19 аминокислотных остатков , включая необычные аминокислоты трео -3-метил-лантионин, мезолантионин , лизиноаланин и 3-гидроксиаспарагиновую кислоту .
Циннамицин принадлежит к классу молекул, известных как лантибиотики , которые относятся к рибосомально синтезированным посттрансляционно модифицированным пептидам. Уникальным рецептором для циннамицина являются липиды фосфатидилэтаноламина (PE), которые являются основным соединением, присутствующим во многих бактериальных клеточных мембранах.
Циннамицин был впервые выделен в 1952 году, а позднее были обнаружены некоторые другие соединения с похожей последовательностью и структурой. [1]
Структура
Циннамицин имеет компактную глобулярную структуру и состоит из следующей общей последовательности аминокислот: [2]
- Ала-Арг-Глн-Ала-Ала-Ала-Фен-Гли-Про-Фен-Абу-Фен-Вал-Ала-Асп-Гли-Асн-Абу-Лиз
Остатки аминокислот основной цепи связаны четырьмя мостиками, включая один мостик мезолантионина (Lan), два мостика (2 S ,3 S ,6 R )-3-метиллантионина (MeLan) и один мостик (2 S ,8 S )-лизиноаланина (LysAla). Сшивание боковой цепи серина и треонина с цистеином дает соответственно мезолантионин (Lan) и метиллантионин (MeLan). Наличие этих тиоловых мостиков вместе с мостиком лизиноаланина делает циннамицин одним из самых маленьких пептидов с хорошо организованной трехмерной структурой. На основании экспериментов ЯМР связывающий карман циннамицина состоит из 7-14 аминокислотных остатков, которые могут вмещать субстрат фосфатидилэтаноламин (PE). Этот меньший размер связывающего кармана делает циннамицин специфичным для его рецептора (PE). Однако функция эритро-3-гидрокси-L-аспарагиновой кислоты (HyAsp) в остатке 15 не очень выражена. [3]
Пептиды дурамицин и анковенин также можно считать принадлежащими к семейству циннамицина. Эти пептиды также состоят из структуры, похожей на циннамицин, как глобулярные пептиды из 19 аминокислот с одним Lan, двумя MeLan и необычным лизиноланиновым мостиком между Lys-19 и Ser-6. Они также демонстрируют модификацию в положении 15, гидроксилирование аспартата, дающее эритро-3-гидроксиаспарагиновую кислоту. Среди группы циннамицина анковенин является наиболее отличающимся вариантом, поскольку он не обладает модификацией аспартата 15 и лизин-аланиновым мостиком. [3] [4]
Взаимодействие рецептора и молекулы
Циннамицин селективно связывается со своим рецептором фосфатидилэтаноламином (PE), который находится во внутреннем слое плазматической мембраны со стехиометрией 1:1. На основании исследований ЯМР было высказано предположение, что эта селективность циннамицина к PE обусловлена связыванием первичной аммониевой группы головной группы PE в небольшой карман связывания на поверхности пептида, который не может вместить более крупные головные группы, такие как, например, фосфатидилхолин. [3]
Цинамицин в основном взаимодействует с PE через сеть водородных связей, образованную между липидным аммонием и карбонилом основной цепи Phe7 и Val13. Аммониевая группа PE также взаимодействует с гидроксильными и карбоксилатными группами HyAsp15. Помимо этого сайта связывания аммония, водороды основной цепи амида остатков 10−13 также имеют решающее значение в связывании липидного фосфата.
Также сообщалось, что дурамицин и циннамицин способствуют связыванию мембраны, вызывая трансбислоевое движение липидов и изменяя кривизну присутствующей в ПЭ мембраны при связывании, поскольку циннамицин предпочтительно связывается с сильно изогнутыми липидными мембранами. [5] [6]
Кластер генов циннамицина –Цин
Генетические исследования показали, что четыре гена cinA, cinM, cinX и cinorf7 играют важную роль в биосинтезе циннамицина. cinA кодирует пептид-предшественник циннамицина. Белки семейства LanM, кодируемые геном cinM, отвечают за дегидратацию остатков серина и треонина в пропептиде с последующим образованием лантиониновых мостиков. CinX кодирует белок, катализирующий гидроксилирование аспартата в позиции 15. Кроме того, cinorf7, как указывается, играет решающую роль в образовании лизиноланинового мостика. [7]
Биосинтез
Лантибиотики представляют собой группу рибосомально синтезированных, посттрансляционно модифицированных антимикробных пептидов с характерными лантиониновыми (Lan) и метиллантиониновыми (MeLan) тиоэфирными сшивками. Биосинтез циннамицина кодируется кластером биосинтетических генов cin , и синтез инициируется, когда структурный ген lanA кодирует пептид-предшественник, который несет N-концевое расширение, называемое «лидерным пептидом», длиной 59 аминокислотных остатков, распознается различными ферментами для обработки C-концевого пропептида, который имеет длину 19 аминокислотных остатков и будет преобразован в циннамицин посредством посттрансляционных модификаций. Первым шагом в образовании мостиков Lan/MeLan является дегидратация остатков серина и треонина с образованием дегидроаланина (Dha) и дегидробутирина (Dhb) соответственно. Они подвергаются внутримолекулярному присоединению Михаэля с соседними остатками цистеина, образуя тиоэфирные мостики. Циннамицин относится к лантибиотикам класса II , в которых как дегидратация, так и циклизация катализируются бифункциональным ферментом LanM. После обработки основного пептида лидерный пептид протеолитически отщепляется от зрелого пептида. [8]
Посттрансляционные модификации циннамицина включают образование лантиониновых мостиков, образование лизиноланинового (Lal) мостика между лизином 19 и серином 6 и гидроксилированиеL-аспартат в положении 15.
В большинстве лантибиотиков класса II присутствует мотив расщепления протеазой GG или GA, тогда как в циннамицине присутствует мотив AXA между лидерной последовательностью и центральной областью CinA.
В кластере генов отсутствует специфическая для циннамицина протеаза, поэтому последовательность распознается сигнальной пептидазой типа I общего секреторного ( sec ) пути. Ферменты, ответственные за гидроксилирование Asp и образование мостика Lal, еще не обнаружены. [9]
Механизм иммунитета
Уникальный механизм иммунитета присутствует в продуцирующем штамме Streptomyces cinnamoneus против ингибирующего действия его собственного продукта. В целом циннамицин выполняет свою антимикробную активность путем связывания с фосфатидилэтаноламином, который является основным мембранным липидом стрептомицетов. Для защиты продуцирующего штамма ген cinorf10 кодирует монометилтрансферазу PE, которая катализирует реакцию метилирования PE. Эта транскрипция cinorf10 начинается при очень низких уровнях циннамицина, чтобы гарантировать, что значительное количество PE метилировано до высокого уровня производства циннамицина. Исходя из структуры комплекса циннамицин-PE, монометилированный PE не будет помещаться в связывающий карман циннамицина, и ингибирующее действие больше не будет поддерживаться. [10]
Соединения, подобные циннамицину
На основе классификации Юнга 1991 года существует два типа лантибиотиков : тип А и тип В. Лантибиотики типа А представляют собой удлиненные, гибкие, стержневидные молекулы, которые положительно заряжены и действуют на бактериальные мембраны путем образования пор. В отличие от них лантибиотики типа В имеют негибкую глобулярную структуру из-за наличия характерных поперечных связей голова-хвост. Эта группа молекул несет отрицательный заряд или не имеет чистого заряда и мешает различным ферментам, участвующим в биосинтезе клеточной стенки. [8]
Циннамицин тесно связан с лантибиотиками типа B дурамицином, дурамицином B, дурамицином C и анковенином. Все эти соединения получены из 19-aa пропептидов и имеют один Lan, два MeLan и необычный лизиноланиновый мостик между Lys-19 и Ser-6 и эритро-3-гидрокси-L-аспарагиновую кислоту в положении 15, которая опосредует взаимодействие между циннамицином и его биологической мишенью фосфатидилэтаноламином и, следовательно, важна для их антимикробной активности. Все они вырабатываются актиномицетами , дурамицины и циннамицин исключительно стрептомицетами. [7]
Биологическая активность
В дополнение к антимикробным свойствам, циннамицин-подобные пептиды проявляют ингибирующее действие на ангиотензинпревращающий фермент , активность фосфолипазы А2 , пролиферацию вируса простого герпеса , простагландин и биосинтез лейкотриенов . Кроме того, он ингибирует рост Bacillus subtilis , анаэробных бактерий, грибов и дрожжей (хотя и менее интенсивно). [7] [11]
Эти пептиды также способны лечить регуляцию артериального давления, воспаление и вирусную инфекцию. Эти молекулы состоят из четко определенного кармана, созданного четырьмя циклизационными событиями, и распознают фосфатидилэтаноламин (ПЭ) с высоким сродством и селективностью. Эта способность селективно связываться с липидами ПЭ делает циннамицин идеальным зондом для обнаружения местоположения мембран, содержащих ПЭ, таких как раковые клетки, и для их разрушения. [3]
Такие соединения, как дурамицин и циннамицин, которые нарушают связь PE с рецепторами фосфатидилсерина, необходимыми для проникновения многих оболочечных вирусов, являются многообещающей стратегией для широкого спектра противовирусной активности. [12] Циннамицин связывается с субстратом фосфолипазы A2 , фосфатидилэтаноламином (PE) с высокой специфичностью в соотношении 1:1, и это связывание изменяет работу ионных каналов. Эта особенность используется в фармацевтической промышленности для лечения муковисцидоза. Кроме того, PLA2 катализирует реакцию высвобождения арахидоновой кислоты из фосфолипидов в клеточных мембранах, которая является предшественником синтеза эйкозаноидов, которые связаны с воспалением. Такие лантибиотики также могут использоваться для регуляции воспалительных процессов. Ингибирование PLA2 также связано с лечением некоторых заболеваний, таких как атеросклероз , диабет и рак . [9] [11]
Ссылки
- ^ Ван, Сяоци; Гу, Цин; Брейкинк, Эфьян (01 августа 2020 г.). «Нелипидные II, нацеленные на лантибиотики». Biochimica et Biophysical Acta (BBA) – Биомембраны . МЕМБРАННЫЕ ЭФФЕКТОРЫ И ПРИВОДЫ. 1862 (8): 183244. doi : 10.1016/j.bbamem.2020.183244 . ISSN 0005-2736. PMID 32126235. S2CID 212406013.
- ^ Кесслер, Хорст; Стойернагель, Стефан; Уилл, Мартин; Юнг, Гюнтер; Келлнер, Роланд; Гиллессен, Дитер; Камияма, Цутому (1988). «Структура полициклического нонадекапептида Ro 09-0198». Helvetica Chimica Acta . 71 (8): 1924–1929 . doi : 10.1002/hlca.19880710811. ISSN 1522-2675.
- ^ abcd Вестергаард, Миккель; Берглунд, Нильс Антон; Хсу, Пин-Чиа; Сонг, Чен; Колдсё, Хайди; Шиотт, Биргит; Сансом, Марк СП (12.11.2019). «Структура и динамика комплексов циннамицин–липид: механизмы селективности для фосфатидилэтаноламиновых липидов». ACS Omega . 4 (20): 18889– 18899. doi :10.1021/acsomega.9b02949. PMC 6854821 . PMID 31737850.
- ^ Гомес, Карен Мачадо; Дуарте, Рафаэль Силва; де Фрейре Бастос, Мария ду Карму (01 февраля 2017 г.). «Лантибиотики, продуцируемые актинобактериями, и их потенциальное применение (обзор)». Микробиология . 163 (2): 109–121 . doi : 10.1099/mic.0.000397 . ISSN 1350-0872. ПМИД 28270262.
- ^ Макино, Асами; Баба, Такеши; Фудзимото, Кадзуси; Ивамото, Кунихико; Яно, Ёсиаки; Терада, Нобуо; Оно, Шиничи; Сато, Сатоши Б.; Охта, Акинори; Умеда, Масато; Мацузаки, Кацуми (январь 2003 г.). «Циннамицин (Ro 09-0198) способствует связыванию клеток и токсичности, индуцируя трансбислойное движение липидов». Журнал биологической химии . 278 (5): 3204–3209 . doi : 10.1074/jbc.M210347200 . ПМИД 12446685.
- ^ Ивамото, Кунихико; Хаякава, Томохиро; Мурате, Мотохидэ; Макино, Асами; Ито, Казуки; Фудзисава, Тетсуро; Кобаяши, Тосихидэ (сентябрь 2007 г.). «Зависимое от кривизны распознавание этаноламиновых фосфолипидов дурамицином и циннамицином». Biophysical Journal . 93 (5): 1608– 1619. Bibcode :2007BpJ....93.1608I. doi :10.1529/biophysj.106.101584. PMC 1948045 . PMID 17483159.
- ^ abc Widdick, DA; Dodd, HM; Barraille, P.; White, J.; Stein, TH; Chater, KF; Gasson, MJ; Bibb, MJ (2003-04-01). "Клонирование и инженерия кластера генов биосинтеза циннамицина из Streptomyces cinnamoneus cinnamoneus DSM 40005". Труды Национальной академии наук . 100 (7): 4316– 4321. Bibcode : 2003PNAS..100.4316W. doi : 10.1073/pnas.0230516100 . ISSN 0027-8424. PMC 153090. PMID 12642677 .
- ^ ab МакОлифф, Оливия; Росс, Р. Пол; Хилл, Колин (май 2001 г.). «Лантибиотики: структура, биосинтез и способ действия». FEMS Microbiology Reviews . 25 (3): 285–308 . doi : 10.1111/j.1574-6976.2001.tb00579.x . ISSN 1574-6976. PMID 11348686.
- ^ ab Ökesli, Ayşe; Cooper, Lisa E.; Fogle, Emily J.; van der Donk, Wilfred A. (2011-08-31). "Девять посттрансляционных модификаций во время биосинтеза циннамицина". Журнал Американского химического общества . 133 (34): 13753– 13760. doi :10.1021/ja205783f. ISSN 0002-7863. PMC 3163434. PMID 21770392 .
- ^ Репка, Линдси М.; Чекан, Джонатан Р.; Наир, Сатиш К.; ван дер Донк, Вильфред А. (2017-04-26). «Механистическое понимание ферментов биосинтеза лантипептидов». Chemical Reviews . 117 (8): 5457– 5520. doi :10.1021/acs.chemrev.6b00591. ISSN 0009-2665. PMC 5408752 . PMID 28135077.
- ^ Аб Гомес, Карен Мачадо; Дуарте, Рафаэль Силва; де Фрейре Бастос, Мария ду Карму (01 февраля 2017 г.). «Лантибиотики, продуцируемые актинобактериями, и их потенциальное применение (обзор)». Микробиология . 163 (2): 109–121 . doi : 10.1099/mic.0.000397 . ISSN 1350-0872. ПМИД 28270262.
- ^ Кодани, Шинья; Комаки, Хисаюки; Ишимура, Шо; Хемми, Хикару; Ониши-Камеяма, Маюми (2016-08-01). «Выделение и определение структуры нового лантибиотика циннамицина B из Actinomadura atramentaria на основе анализа генома». Журнал промышленной микробиологии и биотехнологии . 43 (8): 1159– 1165. doi : 10.1007/s10295-016-1788-9. hdl : 10297/10284 . ISSN 1476-5535. PMID 27255974. S2CID 18281351.
