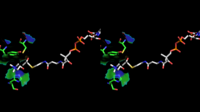
- Кристаллическая структура иона холина, связанного в холинацетилтрансферазе. Показаны остатки боковой цепи His324A и Tyr552A. PDB : 2FY3
Холинацетилтрансфераза
| Холинацетилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.6 | ||||||||
| Номер CAS | 9012-78-6 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| ЧАТ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CHAT , CHOACTASE, CMS1A, CMS1A2, CMS6, холин-O-ацетилтрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 118490; МГИ : 88392; гомологен : 40693; GeneCards : ЧАТ; ОМА :ЧАТ - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Холинацетилтрансфераза (обычно сокращенно ChAT , но иногда CAT ) — фермент трансфераза, ответственный за синтез нейротрансмиттера ацетилхолина . ChAT катализирует перенос ацетильной группы от кофермента ацетил-КоА к холину , в результате чего образуется ацетилхолин (ACh). ChAT в высокой концентрации содержится в холинергических нейронах , как в центральной нервной системе (ЦНС), так и в периферической нервной системе (ПНС). Как и большинство белков нервных окончаний, ChAT вырабатывается в теле нейрона и транспортируется в нервное окончание , где его концентрация самая высокая. Наличие ChAT в нервной клетке классифицирует эту клетку как «холинергический» нейрон. У людей фермент холинацетилтрансфераза кодируется геном CHAT . [ 5]
История
Холинацетилтрансфераза была впервые описана Дэвидом Нахмансоном и А. Л. Мачадо в 1943 году. [6] Немецкий биохимик Нахмансон изучал процесс проведения нервного импульса и использования химических реакций с выделением энергии в клетках, развивая работы нобелевских лауреатов Отто Варбурга и Отто Мейерхофа по ферментации , гликолизу и сокращению мышц . Основываясь на предыдущих исследованиях, показывающих, что «действие ацетилхолина на структурные белки» отвечает за нервные импульсы, Нахмансон и Мачадо исследовали происхождение ацетилхолина. [7]
Из мозга и нервной ткани был извлечен фермент, который образует ацетилхолин. Образование происходит только в присутствии аденозинтрифосфата (АТФ) . Фермент называется холинацетилаза.
— Нахмансон и Мачадо, 1943 [6]
Механизм действия ацетилтрансферазы был неизвестен на момент этого открытия, однако Нахмансон предположил возможность обмена ацетилфосфата или фосфорилхолина на фосфат (из АТФ ) на холин или ацетатный ион. [6] Только в 1945 году кофермент А (КоА) был открыт одновременно и независимо тремя лабораториями, [8] [9] [10] Нахмансон был одной из них. Впоследствии, ацетил-КоА, в то время называемый «активным ацетатом», был открыт в 1951 году. [11] Трехмерная структура ChAT, полученного от крыс, была решена только спустя почти 60 лет, в 2004 году. [12]
Структура
Трехмерная структура ChAT была решена с помощью рентгеновской кристаллографии PDB : 2FY2 . Холин связан в активном центре ChAT нековалентными взаимодействиями между положительно заряженным амином холина и гидроксильной группой Tyr552, в дополнение к водородной связи между гидроксильной группой холина и остатком гистидина His324.
Холиновый субстрат помещается в карман внутри ChAT, в то время как ацетил-КоА помещается в карман на поверхности белка. Трехмерная кристаллическая структура показывает, что ацетильная группа ацетил-КоА примыкает к карману связывания холина, что минимизирует расстояние между донором и реципиентом ацетил-группы.
Гомология
ChAT очень консервативен в геноме животных. Среди млекопитающих, в частности, наблюдается очень высокое сходство последовательностей. Например, ChAT человека и кошки ( Felis catus ) имеют 89% идентичности последовательностей. Идентичность последовательностей с Drosophila составляет около 30%. [13]
Формы ЧАТ
Существует две формы ChAT: растворимая форма и связанная с мембраной форма. [14] Растворимая форма отвечает за 80-90% общей активности фермента, в то время как связанная с мембраной форма отвечает за оставшиеся 10-20% активности. [15] Однако уже давно ведутся споры о том, как последняя форма ChAT связана с мембраной. [16] Связанная с мембраной форма ChAT связана с синаптическими пузырьками. [17]
Общие и периферические изоформы ChAT
Существует две изоформы ChAT, обе кодируются одной и той же последовательностью. Общий тип ChAT (cChAT) присутствует как в ЦНС, так и в ПНС. Периферический тип ChAT (pChAT) преимущественно экспрессируется в ПНС у людей и возникает из-за пропуска экзонов (экзоны 6–9) во время посттранскрипционной модификации . Таким образом, аминокислотная последовательность очень похожа; однако в pChAT отсутствуют части последовательности, присутствующие в cChAT. Изоформа pChAT была открыта в 2000 году на основе наблюдений, что антитела к ChAT, полученные из мозга, не окрашивали периферические холинергические нейроны, как они это делают для тех, которые находятся в мозге. Этот механизм сплайсинга генов , который приводит к различиям cChAT и pChAT, наблюдался у различных видов, включая как позвоночных млекопитающих, так и беспозвоночных моллюсков, что позволяет предположить, что этот механизм приводит к некоторому пока не идентифицированному эволюционному преимуществу.
Функция

Холинергические системы участвуют в многочисленных неврологических функциях. Изменения в некоторых холинергических нейронах могут быть причиной нарушений при болезни Альцгеймера . Белок, кодируемый этим геном, синтезирует нейротрансмиттер ацетилхолин . Ацетилхолин действует на два класса рецепторов в центральной нервной системе — мускариновые и никотиновые , — каждый из которых участвует в различных физиологических реакциях. Роль ацетилхолина в никотиновых рецепторах все еще изучается. Вероятно, он участвует в путях вознаграждения/подкрепления, на что указывает вызывающая привыкание природа никотина , который также связывается с никотиновыми рецепторами. Мускариновое действие ацетилхолина в ЦНС участвует в обучении и памяти. Потеря холинергической иннервации в неокортексе связана с потерей памяти, как это подтверждается в запущенных случаях болезни Альцгеймера. В периферической нервной системе холинергические нейроны участвуют в регуляции висцеральных функций, таких как, помимо прочего, сокращение сердечной мышцы и функция желудочно-кишечного тракта.
Его часто используют в качестве иммуногистохимического маркера двигательных нейронов (мотонейронов).
Мутации
Мутанты ChAT были выделены у нескольких видов, включая C. elegans , Drosophila и человека. Большинство нелетальных мутантов, имеющих фенотип недикого типа, проявляют некоторую активность, но значительно меньшую, чем дикий тип.
У C. elegans несколько мутаций в ChAT были прослежены до гена cha-1. Все мутации приводят к значительному снижению активности ChAT. Процент потери активности может превышать 98% в некоторых случаях. Фенотипические эффекты включают замедленный рост, уменьшение размера, нескоординированное поведение и отсутствие чувствительности к ингибиторам холинэстеразы . [19] Изолированные температурно-чувствительные мутанты у Drosophila все были летальными. Перед смертью пораженные мухи демонстрируют изменение поведения, включая неконтролируемые движения и изменение активности электроретинограммы . [20]
Человеческий ген, ответственный за кодирование ChAT, — CHAT. Мутации в CHAT связаны с врожденным миастеническим синдромом , заболеванием, которое приводит к общему дефициту двигательных функций и слабости. Другие симптомы включают фатальное апноэ . Из десяти изолированных мутантов, у 1 было показано полное отсутствие активности, у 8 было показано значительное снижение активности, а у 1 была неизвестная функция. [21]
Клиническое значение
болезнь Альцгеймера
Болезнь Альцгеймера (БА) связана с трудностями в памяти и познании. Концентрации ацетилхолина и ChAT значительно снижены в неокортексе и гиппокампе головного мозга. [22] Хотя потеря клеток и дисфункция холинергических нейронов считаются фактором, способствующим болезни Альцгеймера, они, как правило, не рассматриваются как основной фактор развития этого заболевания. Предполагается, что агрегация и отложение белка бета-амилоида нарушает метаболизм нейронов и дополнительно повреждает холинергические аксоны в коре и холинергические нейроны в базальном переднем мозге. [23]
Боковой амиотрофический склероз
Боковой амиотрофический склероз (БАС) является одним из наиболее распространенных заболеваний двигательных нейронов. Значительная потеря иммунореактивности ChAT обнаруживается при БАС. [24] Предполагается, что холинергическая функция участвует в неконтролируемом увеличении внутриклеточной концентрации кальция, причина которого до сих пор остается неясной. [25]
Наркотики
Неостигмина метилсульфат, антихолинэстеразный агент, использовался для воздействия на ChAT. В частности, было показано, что использование неостигмина метилсульфата оказывает положительное воздействие против врожденного миастенического синдрома. [26]
Было показано, что воздействие эстрадиола увеличивает уровень ChAT у самок крыс. [27]
Смотрите также
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000070748 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000021919 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Strauss WL, Kemper RR, Jayakar P, Kong CF, Hersh LB, Hilt DC, Rabin M (февраль 1991 г.). «Ген холинацетилтрансферазы человека картируется в области 10q11-q22.2 с помощью гибридизации in situ». Genomics . 9 (2): 396–8. doi : 10.1016/0888-7543(91)90273-H . PMID 1840566.
- ^ abc Nachmansohn D, Machado AL (1943). «Образование ацетилхолина. Новый фермент: холинацетилаза». J. Neurophysiol . 6 (5): 397–403. doi :10.1152/jn.1943.6.5.397.
- ^ Берман Р., Уилсон ИБ, Нахмансон Д. (сентябрь–октябрь 1953 г.). «Специфичность ацетилазы холина в отношении биологической функции». Biochimica et Biophysica Acta . 12 (1–2): 315–24. doi :10.1016/0006-3002(53)90150-4. PMID 13115440.
- ^ Липманн Ф., Каплан НО (1946). «Общий фактор ферментативного ацетилирования сульфаниламида и холина». J. Biol. Chem . 162 (3): 743–744. doi : 10.1016/S0021-9258(17)41419-0 .
- ^ Lipton MA (1946). «Механизм ферментативного синтеза ацетилхолина». Fed. Proc . 5 (1 Pt 2): 145. PMID 21066687.
- ^ Нахмансон Д., Берман М. (1946). «Исследования холинацетилазы; о приготовлении кофермента и его влиянии на фермент». J. Biol. Chem . 165 (2): 551–63. doi : 10.1016/S0021-9258(17)41168-9 . PMID 20276121.
- ^ Джонс Д. Х., Нельсон В. Л. (1968). «Метод выделения продуктов кофермента А». Anal. Biochem . 26 (3): 350–7. doi :10.1016/0003-2697(68)90195-4. PMID 5716187.
- ^ Говиндасами Л, Педерсен Б, Лиан В, Кукар Т, Гу Ю, Джин С, Агбандже-Маккенна М, Ву Д, Маккенна Р (ноябрь 2004 г.). «Структурные данные и функциональные последствия холин-ацетилтрансферазы». Журнал структурной биологии . 148 (2): 226–35. дои : 10.1016/j.jsb.2004.06.005. ПМИД 15477102.
- ^ Oda Y (ноябрь 1999). «Холинацетилтрансфераза: структура, распределение и патологические изменения в центральной нервной системе». Pathology International . 49 (11): 921–37. doi :10.1046/j.1440-1827.1999.00977.x. PMID 10594838. S2CID 23621617.
- ^ Тандон А., Бачу М., Уэлдон П., Полоса С., Коллиер Б. (1996). «Влияние применения колхицина к преганглионарным аксонам на активность холинацетилтрансферазы и содержание и высвобождение ацетилхолина в верхнем шейном ганглии». J. Neurochem . 66 (3): 1033–41. doi :10.1046/j.1471-4159.1996.66031033.x. PMID 8769864. S2CID 44586742.
- ^ Pahud G, Salem N, van de Goor J, Medilanski J, Pellegrinelli N, Eder-Colli L (25 мая 1998 г.). «Исследование субклеточной локализации мембраносвязанной холинацетилтрансферазы в центральной нервной системе дрозофилы и ее связь с мембранами». European Journal of Neuroscience . 10 (5): 1644–53. doi :10.1046/j.1460-9568.1998.00177.x. PMID 9751137. S2CID 24196247.
- ^ Брюс Г., Херш Л. Б. (декабрь 1987 г.). «Исследования холинацетилтрансферазы, высвобождаемой детергентом из мембранных фракций мозга крысы и человека». Neurochem Res . 12 (12): 1059–66. doi :10.1007/bf00971705. PMID 2450285. S2CID 4336737.
- ^ Carroll PT (1994). «Связанная с мембраной холин-O-ацетилтрансфераза в ткани гиппокампа крысы связана с синаптическими пузырьками». Brain Res . 633 (1–2): 112–8. doi :10.1016/0006-8993(94)91529-6. PMID 8137149. S2CID 1139292.
- ^ Рэнд, Джеймс. «Ацетилхолин». WormBook.
- ^ Rand JB, Russell RL (февраль 1984). «Холинацетилтрансферазодефицитные мутанты нематоды Caenorhabditis elegans». Genetics . 106 (2): 227–48. doi :10.1093/genetics/106.2.227. PMC 1202253 . PMID 6698395.
- ^ Гринспен Р. Дж. (1980). «Мутации холинацетилтрансферазы и связанные с ними невральные дефекты». Журнал сравнительной физиологии . 137 (1): 83–92. doi :10.1007/BF00656920. S2CID 45897606.
- ^ Ohno K, Tsujino A, Brengman JM, Harper CM, Bajzer Z, Udd B, Beyring R, Robb S, Kirkham FJ, Engel AG (13 февраля 2001 г.). «Мутации ацетилтрансферазы холина вызывают миастенический синдром, связанный с эпизодическим апноэ у людей». Труды Национальной академии наук . 98 (4): 2017–2022. Bibcode : 2001PNAS ...98.2017O. doi : 10.1073/pnas.98.4.2017 . PMC 29374. PMID 11172068.
- ^ Bartus RT, Dean RL, Beer B, Lippa AS (30 июля 1982 г.). «Холинэргическая гипотеза гериатрической дисфункции памяти». Science . 217 (4558): 408–14. Bibcode :1982Sci...217..408B. doi :10.1126/science.7046051. PMID 7046051.
- ^ Geula C, Mesulam MM, Saroff DM, Wu CK (январь 1998). «Связь между бляшками, клубками и потерей корковых холинергических волокон при болезни Альцгеймера». J Neuropathol Exp Neurol . 57 (1): 63–75. doi : 10.1097/00005072-199801000-00008 . PMID 9600198.
- ^ Ода Y, Имаи S, Наканиши I, Ичикава T, Дегучи T (декабрь 1995 г.). «Иммуногистохимическое исследование холинацетилтрансферазы в спинном мозге пациентов с боковым амиотрофическим склерозом». Pathol Int . 45 (12): 933–9. doi :10.1111/j.1440-1827.1995.tb03418.x. PMID 8808298. S2CID 23763400.
- ^ Morrison BM, Morrison JH (январь 1999). «Амиотрофический боковой склероз, связанный с мутациями в супероксиддисмутазе: предполагаемый механизм дегенерации». Brain Res Brain Res Rev. 29 ( 1): 121–35. doi :10.1016/s0165-0173(98)00049-6. PMID 9974153. S2CID 28937351.
- ^ Грир М., Шотланд М. (июль 1960 г.). «Миастения гравис у новорожденных». Педиатрия . 26 : 101–8. doi : 10.1542/peds.26.1.101. PMID 13851666. S2CID 8672902.
- ^ Luine VN (август 1985). «Эстрадиол увеличивает активность холинацетилтрансферазы в определенных базальных ядрах переднего мозга и проекционных областях самок крыс». Experimental Neurology . 89 (2): 484–90. doi :10.1016/0014-4886(85)90108-6. PMID 2990988. S2CID 1525252.
Дальнейшее чтение
- Ода Y (2000). «Холинацетилтрансфераза: структура, распределение и патологические изменения в центральной нервной системе». Pathol. Int . 49 (11): 921–37. doi :10.1046/j.1440-1827.1999.00977.x. PMID 10594838. S2CID 23621617.
- Wang J, Fu X, Zhang D, Yu L, Li N, Lu Z, Gao Y, Wang M, Liu X, Zhou C, Han W, Yan B, Wang J (2017). «ChAT-положительные нейроны участвуют в нейрогенезе субвентрикулярной зоны после окклюзии средней мозговой артерии у мышей». Behav. Brain Res . 316 : 145–151. doi : 10.1016/j.bbr.2016.09.007. PMC 5048585. PMID 27609645 .
- Oda Y, Nakanishi I, Deguchi T (1993). «Комплементарная ДНК для человеческой холинацетилтрансферазы индуцирует две формы фермента с разным молекулярным весом в культивируемых клетках». Brain Res. Mol. Brain Res . 16 (3–4): 287–94. doi :10.1016/0169-328X(92)90237-6. PMID 1337937.
- Wang J, Lu Z, Fu X, Zhang D, Yu L, Li N, Gao Y, Liu X, Yin C, Ke J, Li L, Zhai M, Wu S, Fan J, Lv L, Liu J, Chen X, Yang Q, Wang J (2017). «Путь сигнализации никотинового рецептора альфа-7 участвует в нейрогенезе, вызванном ChAT-положительными нейронами в субвентрикулярной зоне». Transl Stroke Res . 8 (5): 484–493. doi :10.1007/s12975-017-0541-7. PMC 5704989. PMID 28551702 .
- Туссен JL, Жоффруа V, Шмитт M, Вернер A, Гарнье JM, Симони P, Кемпф J (1992). "Человеческая холинацетилтрансфераза (CHAT): частичная последовательность гена и потенциальные контрольные области". Геномика . 12 (2): 412–6. doi :10.1016/0888-7543(92)90395-9. PMID 1339386.
- Lorenzi MV, Trinidad AC, Zhang R, Strauss WL (1992). «Две мРНК транскрибируются с человеческого гена холинацетилтрансферазы». DNA Cell Biol . 11 (8): 593–603. doi :10.1089/dna.1992.11.593. PMID 1388731.
- Misawa H, Ishii K, Deguchi T (1992). "Экспрессия гена мышиной холинацетилтрансферазы. Альтернативный сплайсинг и идентификация высокоактивной промоторной области". J. Biol. Chem . 267 (28): 20392–9. doi : 10.1016/S0021-9258(19)88714-8 . PMID 1400357.
- Cervini R, Rocchi M, DiDonato S, Finocchiaro G (1992). «Выделение и субхромосомная локализация фрагмента ДНК гена холинацетилтрансферазы человека». Neurosci. Lett . 132 (2): 191–4. doi :10.1016/0304-3940(91)90299-9. PMID 1784419. S2CID 23030200.
- Strauss WL, Kemper RR, Jayakar P, Kong CF, Hersh LB, Hilt DC, Rabin M (1991). «Ген холинацетилтрансферазы человека картируется в области 10q11-q22.2 с помощью гибридизации in situ». Genomics . 9 (2): 396–8. doi : 10.1016/0888-7543(91)90273-H . PMID 1840566.
- Viegas-Péquignot E, Berrard S, Brice A, Apiou F, Mallet J (1991). «Локализация фрагмента длиной 900 п.н. гена человеческой холинацетилтрансферазы в 10q11.2 с помощью нерадиоактивной гибридизации in situ». Genomics . 9 (1): 210–2. doi :10.1016/0888-7543(91)90242-7. PMID 2004764.
- Itoh N, Slemmon JR, Hawke DH, Williamson R, Morita E, Itakura K, Roberts E, Shively JE, Crawford GD, Salvaterra PM (1986). "Клонирование кДНК холинацетилтрансферазы дрозофилы". Proc. Natl. Acad. Sci. USA . 83 (11): 4081–5. Bibcode :1986PNAS...83.4081I. doi : 10.1073/pnas.83.11.4081 . PMC 323670 . PMID 3086876.
- Hersh LB, Takane K, Gylys K, Moomaw C, Slaughter C (1988). «Сохранение аминокислотных последовательностей между человеческой и свиной холинацетилтрансферазой». J. Neurochem . 51 (6): 1843–5. doi :10.1111/j.1471-4159.1988.tb01166.x. PMID 3183663. S2CID 24613238.
- Berrard S, Brice A, Lottspeich F, Braun A, Barde YA, Mallet J (1988). «cDNA cloning and complete sequence of porcine choline acetyltransferase: in vitro translation of the related RNA produce an active protein». Proc. Natl. Acad. Sci. USA . 84 (24): 9280–4. doi : 10.1073/pnas.84.24.9280 . PMC 373252 . PMID 3480542.
- Шире MA, Ле Ван Тай A, Вебер MJ (1995). «Ген холинацетилтрансферазы человека: локализация альтернативных первых экзонов». J. Neurosci. Res . 40 (4): 427–38. doi :10.1002/jnr.490400402. PMID 7616604. S2CID 42856768.
- Bausero P, Schmitt M, Toussaint JL, Simoni P, Geoffroy V, Queuche D, Duclaud S, Kempf J, Quirin-Stricker C (1993). «Идентификация и анализ промотора гена холинацетилтрансферазы человека». NeuroReport . 4 (3): 287–90. doi :10.1097/00001756-199303000-00015. PMID 7682855.
- Quirin-Stricker C, Nappey V, Simoni P, Toussaint JL, Schmitt M (1994). «Трансактивация рецепторами тиреоидных гормонов 5'-фланкирующей области гена ChAT человека». Brain Res. Mol. Brain Res . 23 (3): 253–65. doi :10.1016/0169-328X(94)90232-1. PMID 8057782.
- Erickson JD, Varoqui H, Schäfer MK, Modi W, Diebler MF, Weihe E, Rand J, Eiden LE, Bonner TI, Usdin TB (1994). "Функциональная идентификация везикулярного транспортера ацетилхолина и его экспрессия из локуса "холинергического" гена". J. Biol. Chem . 269 (35): 21929–32. doi : 10.1016/S0021-9258(17)31734-9 . PMID 8071310.
- Kengaku M, Misawa H, Deguchi T (1993). «Множественные виды мРНК холинацетилтрансферазы из спинного мозга крысы». Brain Res. Mol. Brain Res . 18 (1–2): 71–6. doi :10.1016/0169-328X(93)90174-N. PMID 8479291.
- Misawa H, Matsuura J, Oda Y, Takahashi R, Deguchi T (1997). "Human choline acetyltransferase mRNAs with different 5'-region produce a 69-kDa major translation product". Brain Res. Mol. Brain Res . 44 (2): 323–33. doi :10.1016/S0169-328X(96)00231-8. PMID 9073174.
- Lönnerberg P, Ibáñez CF (1999). "Новые, специфичные для яичек транскрипты мРНК, кодирующие укороченную на N-конце холинацетилтрансферазу". Mol. Reprod. Dev . 53 (3): 274–81. doi :10.1002/(SICI)1098-2795(199907)53:3<274::AID-MRD3>3.0.CO;2-8. PMID 10369388. S2CID 39464614.
- Сакакибара А., Хаттори С. (2000). «Chat, связанный с Cas/HEF1 адаптерный белок, который интегрирует несколько сигнальных путей». J. Biol. Chem . 275 (9): 6404–10. doi : 10.1074/jbc.275.9.6404 . PMID 10692442.
Внешние ссылки
- Холин+ацетилтрансфераза в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)