Шаперонно-ашерные фимбрии
Шаперон-ашерные фимбрии (CU) представляют собой линейные , неразветвленные пили внешней мембраны , секретируемые грамотрицательными бактериями через систему шаперон-ашер, а не через секрецию типа IV или внеклеточные системы зародышеобразования. Эти фимбрии состоят из модульных субъединиц пилей, которые транспортируются в периплазму зависимым от Sec образом. Шаперон-ашерные секретируемые фимбрии являются важными факторами патогенности , облегчающими колонизацию хозяина , локализацию и образование биопленки у клинически важных видов, таких как уропатогенные Escherichia coli и Pseudomonas aeruginosa .
Структура
Общий
Все системы шаперонов/ашеров находятся в кластерах генов, состоящих по крайней мере из ашера , шаперона и одной или нескольких субъединиц фимбрий. [1] В целом система включает периплазматические шапероны, периплазматические и внеклеточные субъединицы пилей , димерную внешнюю мембранную пору ашера и связанный с ней механизм Sec. Субъединицы пилей полимеризуются посредством нековалентного взаимодействия , образуя зрелые пили, которые состоят из адгезивного кончика, спирального тела и связанного с ашером основания. Система P-пилей (pap) является одной из наиболее хорошо охарактеризованных и показана ниже. [2]
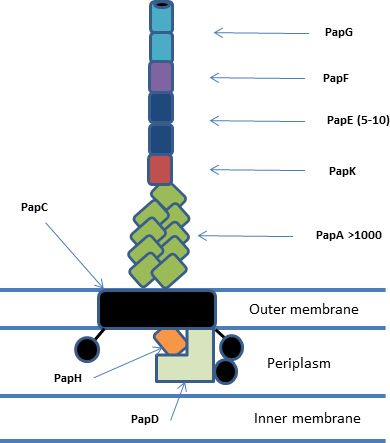
Структура и функции Ашера
Usher образует пору внешней мембраны и функционирует in vivo как димер , хотя только один из usher активен в любой момент времени. [3] Usher пора (PapC) образована 24-цепочечным бета-бочкой с 4 дополнительными доменами: N-концевым доменом (NTD), доменом Plug и двумя C-концевыми доменами (CTD1 и CTD2 соответственно). NTD и CTD выполняют функцию доставки комплексов шаперон/субъединица к растущему пилюсу и облегчают транслокацию через пору. [4] Домен Plug действует, чтобы остановить преждевременное образование пилюса и может быть расположен либо внутри поры, либо на периплазматической стороне мембраны. В активном димерном usher один из usher имеет плагин, расположенный периплазматически, а другой - внутри транслокационной поры. [5]
Структура и функция шаперона
Периплазматический шаперон (PapD) имеет структуру «бумеранга», образованную иммуноглобулиновой (Ig) подобной складкой с существенным C-концевым расширением (G1). Эта складка образована 13 β-тяжами (A1-G1) и 4 короткими α-спиралями. Шапероны принадлежат к одному из двух семейств в зависимости от длины петли, соединяющей бета-тяжи F1 и G1. Длиннопетлевые шапероны — это FGL, а короткопетлевые шапероны — это FGS. Шаперон выполняет функцию остановки агрегации и деградации субъединиц пилей, связывая их интерфейсные области и способствуя правильному сворачиванию белка перед тем, как доставить их в комплекс usher/fimbriae. [6]
Структура и функция субъединицы пилина

Структура субъединицы пилуса также имеет Ig-подобную складку, но с существенным N-концевым расширением вместо C-концевого расширения. Поскольку это N-концевое расширение является той же β-нитью, которая обычно завершает складку Ig, в зрелой субъединице (P1-P5) образуется большая гидрофобная щель; эта щель необходима для биогенеза пилуса, но также требует шаперона для стабилизации структуры. [7] Отдельные субъединицы могут иметь дополнительные домены, например, papG имеет адгезивный лектиновый домен. Субъединицы пилуса in vivo функционируют для формирования основного тела спирального пилуса (приблизительно 3,28 субъединицы на виток) и адгезивной головки.
Биогенез
Биогенез пилей происходит через механизм комплементации нитей, механизм функционирует как прямое следствие структур как шаперонов, так и субъединиц пилей. Как расширение G1 шаперона, так и N-концевое расширение субъединиц пилей могут связываться с гидрофобной щелью P1-P5. Когда G1 связан, он связывается в параллельной конформации, стабилизируя структуру субъединицы, но не образует истинную складку Ig (которая является антипараллельной). Он также связывает щель только с участков P1-P4, оставляя карман P5 открытым. Когда другая субъединица связывается с гидрофобной щелью, она связывается в антипараллельном режиме P5-P2, создавая наиболее энергетически выгодную конформацию истинной складки Ig. [1]
Когда комплекс шаперон/субъединица доставляется к растущему комплексу ушер/пилус (обратите внимание, что комплекс шаперон/субъединица образует его основу), NTD и CTD димера ушера доставляют и удерживают комплекс шаперон/субъединица к основанию пилуса. Здесь N-концевое расширение субъединицы взаимодействует со свободным карманом P5 пилуса. Это связывание вызывает «расстегивание молнии» остатка G1 цепи шаперона с одновременным «застегиванием молнии» N-концевого расширения комплекса шаперон/субъединица, неизвестного как механизм zip in-zip out. [2]
После того, как шаперон был перемещен, он диффундирует обратно в механизм sec, чтобы связать другую появляющуюся субъединицу пиля. Ашер, использующий CTD, затем перемещает более длинный пилю через пору транслокации на один остаток, пока шаперон не окажется в тесной связи с ашером. Эта транслокация сопряжена с небольшим вращением, придавая пилю его спиральную структуру. Этот рост продолжается до тех пор, пока терминирующая субъединица не свяжет пилю (если таковая имеется), терминирующие субъединицы не имеют кармана P5 и, таким образом, почти необратимо связывают свой шаперон. Поскольку ашер может перемещать только субъединицы пиля, а не комплексы шаперон/субъединица, и тот факт, что шаперон не может быть энергетически вытеснен другой субъединицей (из-за отсутствия P5), эта терминирующая субъединица прикрепляет пилю к внешней мембране и останавливает любой дальнейший рост пиля. [1]
Номенклатура и классификация
Исторически классификация фимбрий была сделана на основе их внешнего вида под микроскопом, создав 4 класса: Афимбриальные, фимбрии типа 1, образующие пучки (тип IV) пили и курлы . Однако этот тип классификации не дает никакой меры родства и, таким образом, был заменен филогенетической системой. [8]
В фимбриях шаперона/ашера в целом существует два типа классификации: основанная на типе присутствующего ашера или основанная на типе присутствующего шаперона. Использование ашера в качестве основы классификации формирует 5 кладов: альфа, бета, гамма, пи и сигма, и четыре подклада: гамма 1-4. Названия бета и гамма кладов просто алфавитные, тогда как другие названы по определяющему признаку: альфа для альтернативного семейства шаперона/ашера; пи для P-пилуса (ассоциированного с пиелонефритом); и сигма для пилуса оболочки споры от Myxococcus xanthus . [8]
Как было сказано ранее, существует два типа шаперонов: FGL и FGS, и это основа классификации шаперонов. Все шапероны FGL связаны с афимбриальной секрецией, а все шапероны FGS связаны с фимбриальной секрецией. Все шапероны FGL находятся в подкладе гамма-3, все остальные клады и подклады являются FGS. [8]
Патогенность
Шаперон/фимбрии ашера играют много ролей на многих стадиях патогенности у нескольких видов. Наиболее хорошо изучены роли в адгезии, врожденном иммунном уклонении и локализации. Адгезия облегчается лектиновым доменом на кончике шаперон/фимбрии ашера, этот домен FimH хорошо изучен. FimH является первой субъединицей пилей типа I (γ-1 клада) у таких видов, как UPEC, и связывается с D-маннозилированными остатками в мочевом пузыре, обеспечивая адгезию и колонизацию патогена. Иммунное уклонение также облегчается кончиком адгезина, например, связывание фактора ускорения распада (DAF) фимбриями клада gamma3 ингибирует эффективную активацию комплемента. Локализация может быть выполнена путем последовательной экспрессии различных систем шаперона/ашера. Большинство видов патогенных бактерий экспрессируют более одного типа системы шаперона/ашера, например, у Pseudomonas aeruginosa существует пять различных систем. UPEC экспрессирует как фимбрии типа 1, так и P-пили (папу), которые он экспрессирует последовательно, возможно, для облегчения миграции из мочевого пузыря (фимбрии типа I) в почки (папу). [9]
Эта важность патогенности делает систему шаперона/ашера привлекательной целью для новых лекарственных терапий. Нацеливание на патогенность вместо организма (в случае обычных антибиотиков) устраняет сильное селективное давление на развитие резистентности. В случае UPEC был достигнут определенный успех в остановке образования пилей в клинических испытаниях и разработке эффективной вакцины для мышей и яванских макак на основе комплекса FimCH. [9]
Ссылки
- ^ abc Busch A и Waksman G (2012). «Пути шаперона-ашера: разнообразие и механизм сборки пилей». Philosophical Transactions of the Royal Society of London B . 367 (1592): 1112– 1122. doi :10.1098/rstb.2011.0206. PMC 3297437 . PMID 22411982.
- ^ ab Hultgren SJ и Waksman G (2009). «Структурная биология пути шаперон-ашер биогенеза пилей». Nature Reviews Microbiology . 7 (11): 765–774 . doi :10.1038/nrmicro2220. PMC 3790644. PMID 19820722 .
- ^ Вернебург, Гленн Т.; Хендерсон, Надин С.; Портной, Эрика Б.; Саровар, Самема; Халтгрен, Скотт Дж.; Ли, Хуэйлинь; Танасси, Дэвид Г. (июль 2015 г.). «Пилус-ушер контролирует взаимодействия белков посредством маскировки доменов и функционирует как олигомер». Структурная и молекулярная биология природы . 22 (7): 540–546 . doi :10.1038/nsmb.3044. ISSN 1545-9985. ПМЦ 4496297 . ПМИД 26052892.
- ^ Vetsh M, et al. (2006). «Механизм сборки волокон через путь шаперона-ушера». EMBO Reports . 7 (7): 734– 738. doi :10.1038/sj.embor.7400722. PMC 1500831. PMID 16767077 .
- ^ Фан Г и др. (2011). «Кристаллическая структура FimD usher, связанного с его родственным субстратом FimC-FimH». Nature . 474 (7349): 49– 53. doi :10.1038/nature10109. PMC 3162478 . PMID 21637253.
- ^ Sauer F, et al. (1999). «Структурная основа функции шаперона и биогенеза пилей». Science . 285 (5430): 1058– 1061. doi :10.1126/science.285.5430.1058. PMID 10446050.
- ^ Verger D, et al. (2007). "Кристаллическая структура субъединицы P-пилуса rob PapA". PLOS ONE . 3 (5): e73. doi : 10.1371/journal.ppat.0030073 . PMC 1868955 . PMID 17511517.
- ^ abc Nuccio SP, et al. (2007). «Эволюция пути сборки шаперона/ашера: фимбриальная классификация переходит на греческий язык». Microbiology and Molecular Biology Reviews . 71 (4): 551– 575. doi :10.1128/MMBR.00014-07. PMC 2168650. PMID 18063717 .
- ^ ab Beata M, et al. (2011). «Инфекции мочевыводящих путей штаммов Escherichia coli системы шаперон-ашер». Polish Journal of Microbiology . 60 (4): 279–285 . doi : 10.33073/pjm-2011-040 . PMID 22390061.
