Cdc6
| Белок клеточного деления Cdc6/18 | |
|---|---|
| Идентификаторы | |
| Символ | Cdc6 |
| ИнтерПро | IPR016314 |
| Белок репликации ДНК типа Orc1/Cdc6, археи | |
|---|---|
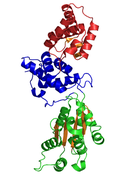 Кристаллическая структура CDC6 из P. aerophilum ( PDB : 1FNN ). Зеленые и синие домены — это домены AAA ; красный домен — это C-концевой домен HTH Cdc6 (информационное поле ниже). [1] | |
| Идентификаторы | |
| Символ | Орк1/Cdc6_arc |
| ИнтерПро | IPR014277 |
| Cdc6/Orc1, C-концевой | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Cdc6_C | ||||||||
| Пфам | ПФ09079 | ||||||||
| ИнтерПро | IPR015163 | ||||||||
| CDD | cd08768 | ||||||||
| |||||||||
Cdc6 , или цикл деления клеток 6 , — это белок эукариотических клеток. Он в основном изучается на почкующихся дрожжах Saccharomyces cerevisiae ( P09119 ). Он является важным регулятором репликации ДНК и играет важную роль в активации и поддержании механизмов контрольных точек в клеточном цикле , которые координируют S-фазу и митоз . Он является частью пререпликативного комплекса (пре-RC) и требуется для загрузки белков обслуживания минихромосом (MCM) на ДНК, что является важным шагом в инициации синтеза ДНК. Кроме того, он является членом семейства AAA+ АТФаз и тесно связан с ORC1 ; оба являются одним и тем же белком в археях . [2]
Функция

CDC6 — это белок, связывающий АТФ , и член пререпликативного комплекса (пре-RC) вместе с комплексом распознавания начала (ORC) , Cdt1 и комплексом MCM (содержащим MCM2-7p). CDC6 собирается после ORC зависимым от АТФ образом и необходим для загрузки белков MCM на ДНК. Реконструкция изображений электронного микроскопа показала, что комплекс ORC-CDC6 образует кольцевую структуру с размерами, аналогичными размерам кольцевой геликазы MCM. [4] Модель с почти атомным разрешением всего комплекса ORC-Cdc6-Cdt1-Mcm2-7 (OCCM) с ДНК была собрана на основе данных ЭМ в 2017 году. [5] Считается, что комплекс CDC6-Cdt1 использует гидролиз АТФ для протягивания ДНК через центральное отверстие пончика MCM. [6] Мутации в мотиве связывания CDC6 убедительно свидетельствуют о том, что связывание и гидролиз АТФ необходимы для его функции. [7] Минимальное требование для связывания ДНК было картировано в ее 47-аминокислотной последовательности. [8] Более того, Cdc6 косвенно ингибирует активацию киназы M фазы p34cdc2/CDC28 , таким образом подавляя ядерное деление. [9]
Регулирование
CDC6 обычно присутствует на высоких уровнях во время фазы G1 клеточного цикла . Это отчасти связано с тем, что ген CDC6 транскрибируется только во время фазы G1. В начале фазы S CDC6 фосфорилируется комплексом Cdc28 - Clb5-Clb6 (Cdk2) и, следовательно, становится инактивированным. Это было показано путем введения мутаций в CDC6 в консенсусных сайтах фосфорилирования Cdk2 (вблизи N-конца), которые ингибируют деградацию. Фосфорилирование может также катализироваться Cdc28-Cln. Затем инактивированный CDC6 направляется на деградацию посредством SCFCDC4-зависимого убиквитинирования и затем деградирует протеасомой . Таким образом, регуляция CDC6 тесно связана с активностью Cdk2, и поскольку активность Cdk2 колеблется один раз за клеточный цикл, накопление и деградация CDC6 также колеблются.
Можно выделить два состояния. В первом состоянии (во время фазы G1) активность Cdk2 низкая, CDC6 может накапливаться, следовательно, пре-RC может быть сформирован, но не активирован. Во втором состоянии активность Cdk2 высокая, CDC6 становится инактивированным, следовательно, пре-RC активируется, но не сформирован. Это изменение гарантирует, что репликация ДНК выполняется только один раз за клеточный цикл. Было показано, что сверхэкспрессия CDC6 не вызывает повторной репликации в родственных клетках, вероятно, из-за ингибирования через CDK, который сбрасывает часы клеточного цикла на G1. Тем не менее, было высказано предположение, что регуляция CDC6 является одним из нескольких избыточных механизмов, которые предотвращают повторную репликацию ДНК в эукариотических клетках. [10]
Структура

Кристаллографическая структура белка, родственного Cdc6/Orc1, из археи Pyrobaculum aerophilum была решена, и были идентифицированы три структурных домена. [1] Домен I и II образуют сайт связывания/гидролиза АТФ и похожи на другие АТФазы AAA+. Домен III структурно связан с доменом крылатой спирали, поэтому может взаимодействовать с исходной ДНК. Из исследований с комплексом загрузки зажима γ E. coli было высказано предположение, что домен III опосредует белок-белковые взаимодействия с другими АТФазами AAA+ в пре-RC, таким образом предполагая, что CDC6 строит гомодимер в своей нативной форме. Домены I и II образуют молекулу в форме кешью, которая связывает АТФ в щели и дополнительно строит сенсорный мотив для распознавания АТФ/АДФ. Считается, что эти домены также опосредуют последующие конформационные изменения. Тем не менее, точные функциональные роли этих доменов остаются неясными. [8]
Болезнь
Было показано, что CDC6 проявляет протоонкогенную активность. Сверхэкспрессия Cdc6 мешает экспрессии генов- супрессоров опухолей INK4/ARF посредством механизма, включающего эпигенетическую модификацию хроматина в локусе INK4/ARF. Кроме того, сверхэкспрессия CDC6 в первичных клетках может способствовать гиперрепликации ДНК и вызывать реакцию старения, аналогичную той, которая вызвана активацией онкогена. Эти результаты указывают на то, что дерегуляция экспрессии CDC6 в клетках человека представляет серьезный риск канцерогенеза. [3] Наблюдалась пониженная регуляция CDC6 при раке простаты , которая была связана с фенотипическими характеристиками агрессивного рака простаты. [11] Кроме того, было отмечено, что Cdc6 значительно повышен при раке шейки матки , раке легких и раке мозга . [12]
Смотрите также
Ссылки
- ^ ab Liu J, Smith CL, DeRyckere D, DeAngelis K, Martin GS, Berger JM (сентябрь 2000 г.). «Структура и функция Cdc6/Cdc18: последствия для распознавания происхождения и контроля контрольных точек». Molecular Cell . 6 (3): 637–648. doi : 10.1016/S1097-2765(00)00062-9 . PMID 11030343.
- ^ Ausiannikava D, Allers T (январь 2017). «Разнообразие репликации ДНК у архей». Genes . 8 (2): 56. doi : 10.3390/genes8020056 . PMC 5333045 . PMID 28146124.
- ^ ab Borlado LR, Méndez J (февраль 2008 г.). "CDC6: от репликации ДНК до контрольных точек клеточного цикла и онкогенеза". Канцерогенез . 29 (2): 237–243. doi : 10.1093/carcin/bgm268 . PMID 18048387.
- ^ Speck C, Chen Z, Li H, Stillman B (ноябрь 2005 г.). «ATPase-зависимое кооперативное связывание ORC и Cdc6 с исходной ДНК». Nature Structural & Molecular Biology . 12 (11): 965–971. doi :10.1038/nsmb1002. PMC 2952294 . PMID 16228006.
- ^ Юань З, Риера А, Бай Л, Сан Дж, Нанди С, Спанос К и др. (март 2017 г.). «Структурная основа загрузки репликативной геликазы Mcm2-7 ORC-Cdc6 и Cdt1». Nature Structural & Molecular Biology . 24 (3): 316–324. doi :10.1038/nsmb.3372. PMC 5503505 . PMID 28191893.
- ^ Lippincott-Schwartz J, Pollard TD, Earnshaw W (2007). Клеточная биология . Saunders Elsevier. стр. 766–767. ISBN 978-1-4160-2255-8.
- ^ Белл СП, Дутта А (2002). «Репликация ДНК в эукариотических клетках». Annual Review of Biochemistry . 71 : 333–374. doi :10.1146/annurev.biochem.71.110601.135425. PMID 12045100.
- ^ ab Feng L, Wang B, Driscoll B, Jong A (май 2000 г.). «Идентификация и характеристика свойств связывания ДНК Cdc6 Saccharomyces cerevisiae». Молекулярная биология клетки . 11 (5): 1673–1685. doi :10.1091/ mbc.11.5.1673 . PMC 14875. PMID 10793143.
- ^ Bueno A, Russell P (июнь 1992 г.). «Двойные функции CDC6: белок дрожжей, необходимый для репликации ДНК, также ингибирует ядерное деление». The EMBO Journal . 11 (6): 2167–2176. doi :10.1002/j.1460-2075.1992.tb05276.x. PMC 556684. PMID 1600944 .
- ^ Drury LS, Perkins G, Diffley JF (октябрь 1997 г.). «Путь Cdc4/34/53 нацеливает Cdc6p на протеолиз в почкующихся дрожжах». The EMBO Journal . 16 (19): 5966–5976. doi :10.1093/emboj/16.19.5966. PMC 1170227. PMID 9312054 .
- ^ Robles LD, Frost AR, Davila M, Hutson AD, Grizzle WE, Chakrabarti R (июль 2002 г.). «Понижение регуляции Cdc6, гена, регулирующего клеточный цикл, при раке простаты». Журнал биологической химии . 277 (28): 25431–25438. doi : 10.1074/jbc.M201199200 . PMID 12006585.
- ^ Lau E, Tsuji T, Guo L, Lu SH, Jiang W (декабрь 2007 г.). «Роль компонентов пререпликативного комплекса (пре-RC) в онкогенезе». FASEB Journal . 21 (14): 3786–3794. doi : 10.1096/fj.07-8900rev . PMID 17690155. S2CID 32435626.
Внешние ссылки
- Cdc6 в базе данных генома дрожжей