CYP17A1
| Стероидная 17-альфа-гидроксилаза/17,20 лиаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.14.19 | ||||||||
| Номер CAS | 9029-67-8 | ||||||||
| Альтернативные имена | P450c17, CYP17A1, стероид 17-альфа-гидроксилаза/17,20 лиаза, CYPXVII, цитохром P450 17A1, цитохром p450 XVIIA1, цитохром P450-C17, цитохром P450, семейство 17, подсемейство A, полипептид 1, стероид 17-альфа-монооксигеназа, цитохром P450c17, 4.1.2.30, 17-альфа-гидроксипрогестерон альдолаза, цитохром P450, подсемейство XVII (стероид 17-альфа-гидроксилаза), стероид 17 альфа-гидроксилаза/17,20 лиаза, IPR033282 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| CYP17A1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CYP17A1 , CPT7, CYP17, P450C17, S17AH, цитохром P450 семейство 17 подсемейство A член 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 609300; МГИ : 88586; гомологен : 73875; Генные карты : CYP17A1; ОМА : CYP17A1 – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер ЕС | 1.14.14.32 1.14.14.19, 1.14.14.32 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
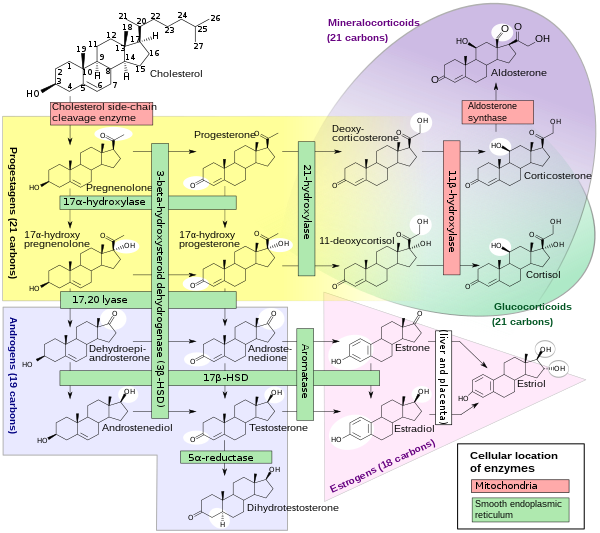
Цитохром P450 17A1 ( стероид 17α-монооксигеназа , 17α-гидроксилаза , 17-альфа-гидроксилаза , 17,20-лиаза , 17,20-десмолаза ) — фермент типа гидроксилазы , который у человека кодируется геном CYP17A1 на хромосоме 10. [ 5] Он повсеместно экспрессируется во многих тканях и типах клеток, включая сетчатую и пучковую зону (но не клубочковую зону ) коры надпочечников , а также ткани половых желез . [6] [7] Он обладает как 17α-гидроксилазной, так и 17,20-лиазной активностью и является ключевым ферментом в стероидогенном пути, который производит прогестины , минералокортикоиды , глюкокортикоиды , андрогены и эстрогены . Более конкретно, фермент действует на прегненолон и прогестерон, добавляя гидроксильную (-ОН) группу в положение углерода 17 (C17) стероидного кольца D (активность 17α-гидроксилазы, EC 1.14.14.19), или действует на 17α-гидроксипрогестерон и 17α-гидроксипрегненолон, отщепляя боковую цепь от стероидного ядра (активность 17,20- лиазы , EC 1.14.14.32). [7]
Структура
Ген
Ген CYP17A1 находится на хромосоме 10 в полосе 10q24.3 и содержит 8 экзонов . [5] КДНК этого гена охватывает длину 1527 п.н. [8] Этот ген кодирует член суперсемейства ферментов цитохрома P450 . Белки цитохрома P450 обычно рассматриваются как монооксигеназы , которые катализируют многие реакции, вовлеченные в метаболизм лекарств и синтез холестерина , стероидов и других липидов , включая замечательное расщепление углерод-углеродной связи, катализируемое этим ферментом.
Ген CYP17A1 также может содержать варианты, связанные с повышенным риском ишемической болезни сердца . [9] [ необходим непервичный источник ]
Белок
CYP17A1 — это белок массой 57,4 кДа , принадлежащий к семейству цитохромов P450. [10] [11] Белок, кодируемый его кДНК, состоит из 508 аминокислотных остатков . Как фермент, CYP17A1 обладает активным сайтом , который ассоциируется с простетической группой гема для катализа биосинтетических реакций. [8] Исходя из его известных структур, при связывании с двумя стероидными ингибиторами, абиратероном и галетероном , CYP17A1 обладает канонической складкой цитохрома P450, присутствующей в других сложных ферментах P450, которые участвуют в стероидогенезе или метаболизме холестерина , хотя он ориентирует стероидные лиганды в направлении спиралей F и G, перпендикулярно группе гема, а не к слою β1. [12] [13]
Выражение
Экспрессия CYP17A1 была обнаружена во всех традиционных стероидогенных тканях , за исключением плаценты , включая сетчатую и пучковую зону надпочечника , клетки Лейдига яичек , текальные клетки яичников и, совсем недавно, в лютеинизированных гранулезных клетках в фолликулах яичников . [ 14] В дополнение к классической стероидогенной ткани, CYP17A1 также был обнаружен в сердце , почках и жировой ткани . [14] У плода CYP17A1 был обнаружен в почках, тимусе и селезенке . [14]
Функция
CYP17A1 является членом суперсемейства ферментов цитохрома P450 , локализованных в эндоплазматическом ретикулуме . Белки этого семейства являются монооксигеназами, которые катализируют синтез холестерина , стероидов и других липидов и участвуют в метаболизме лекарств. [5] CYP17A1 обладает как 17α-гидроксилазной активностью ( EC 1.14.14.19), так и 17,20-лиазной активностью ( EC 1.14.14.32). Активность 17α-гидроксилазы CYP17A1 необходима для образования глюкокортикоидов, таких как кортизол, но как гидроксилазная, так и 17,20-лиазная активность CYP17A1 необходимы для производства андрогенных и эстрогенных половых стероидов путем преобразования 17α-гидроксипрегненолона в дегидроэпиандростерон (ДГЭА) . [15] Мутации в этом гене связаны с изолированным дефицитом стероид-17α-гидроксилазы, дефицитом 17α-гидроксилазы/17,20-лиазы, псевдогермафродитизмом и гиперплазией надпочечников . [5]
Кроме того, активность 17,20-лиазы зависит от цитохрома P450 оксидоредуктазы (POR), цитохрома b5 (CYB5) и фосфорилирования . [16] [17] [18] Цитохром b5 действует как посредник для активности 17,20-лиазы CYP17A1 и может отдавать второй электрон некоторым P450. У людей выработка тестостерона через прегненолон в 17-OHPreg и DHEA CYP17A1 требует POR. [19] [20] Человеческий белок CYP17A1 фосфорилируется по остаткам серина и треонина цАМФ-зависимой протеинкиназой . Фосфорилирование белка увеличивает активность 17,20-лиазы, в то время как дефосфорилирование фактически устраняет эту активность. [18]
Клиническое значение
Мутации в этом гене связаны с редкими формами врожденной гиперплазии надпочечников , в частности с дефицитом 17α-гидроксилазы/дефицитом 17,20-лиазы и изолированным дефицитом 17,20-лиазы . [21]
У людей ген CYP17A1 в значительной степени связан с эндокринными эффектами и метаболизмом стероидных гормонов. [22] [23] [24] Кроме того, мутации в гене CYP17A1 связаны с редкими формами врожденной гиперплазии надпочечников , в частности с дефицитом 17α-гидроксилазы/дефицитом 17,20-лиазы и изолированным дефицитом 17,20-лиазы. В целом, CYP17A1 является важной мишенью для ингибирования при лечении рака простаты, поскольку он вырабатывает андроген, необходимый для роста опухолевых клеток. [25] [26] Сниженная активность фермента CYP17A1 связана с бесплодием из-за гипогонадотропного гипогонадизма. У женщин останавливается фолликулогенез, а у мужчин — атрофия яичек с интерстициальной пролиферацией клеток и остановкой сперматогенеза. Хотя в целом это заболевание ановуляторное, имеются сообщения о некоторых случаях у женщин с дефицитом 17α-гидроксилазы, у которых наступало спонтанное менархе с циклическими менструациями. [27]
Клинический маркер
Исследование оценки генетического риска по нескольким локусам, основанное на комбинации 27 локусов, включая ген CYP17A1, выявило лиц с повышенным риском как инцидентных, так и рецидивирующих событий ишемической болезни сердца, а также улучшенную клиническую пользу от терапии статинами. Исследование было основано на исследовании когорт сообщества (исследование диеты Мальмё и рака) и четырех дополнительных рандомизированных контролируемых испытаниях первичных профилактических когорт (JUPITER и ASCOT) и вторичных профилактических когорт (CARE и PROVE IT-TIMI 22). [9]
Как мишень для наркотиков
Ингибиторы CYP17A1
В настоящее время [ когда? ] FDA одобрило только один ингибитор CYP17A1, абиратерон, который содержит стероидный каркас, аналогичный эндогенным субстратам CYP17A1. Абиратерон структурно похож на субстраты других ферментов цитохрома P450, участвующих в стероидогенезе, и вмешательство может представлять собой ответственность с точки зрения побочных эффектов. Ожидается, что использование нестероидных каркасов позволит разрабатывать соединения, которые более избирательно взаимодействуют с CYP17A1. [26] Мощные ингибиторы фермента CYP17A1 обеспечивают последнюю линию защиты от эктопического андрогенеза при прогрессирующем раке простаты. [28]
Препарат абиратерона ацетат , который используется для лечения кастрационно-резистентного рака простаты , блокирует биосинтез андрогенов, ингибируя фермент CYP17A1. Абиратерона ацетат связывается в активном центре фермента [29] и координирует железо гема через его пиридиновый азот, имитируя субстрат. [30]
С 2014 года галетерон проходит III фазу клинических испытаний при кастрационно-резистентном раке предстательной железы . [31]
Кетоконазол — старый ингибитор CYP17A1 , который сейчас мало используется. Однако кетоконазол конкурентно ингибирует CYP17A1, поэтому его эффективность будет зависеть от концентрации кетоконазола. Это отличается от абиратерона ацетата , который навсегда (а не конкурентно) отключает CYP17A1, как только связывается с ним.
Севитеронел (VT-464) — это новый ингибитор CYP17A1 , который предназначен для предотвращения совместного применения глюкокортоидной терапии. [32] В 2010-х годах он прошел различные фазы клинических исследований и доклинических моделей в качестве препарата против рака предстательной железы или рака молочной железы. [33] [34]
Стероидогенез
 |
Дополнительные изображения
- Нумерация стероидов
Смотрите также
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000148795 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000003555 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ abcd "CYP17A1 цитохром P450 семейство 17 подсемейство A член 1 [Homo sapiens (человек)] - Ген - NCBI". www.ncbi.nlm.nih.gov . Архивировано из оригинала 2015-06-23 . Получено 2016-09-27 .
- ^ "BioGPS - ваша система генного портала". biogps.org . Архивировано из оригинала 2011-08-20 . Получено 11 октября 2016 .
- ^ ab Boulpaep EL, Boron, WF (2005). Медицинская физиология: клеточный и молекулярный подход . Сент-Луис, Миссури: Elsevier Saunders. стр. 1180. ISBN 1-4160-2328-3.
- ^ ab Vasaitis TS, Bruno RD, Njar VC (май 2011 г.). «Ингибиторы CYP17 для терапии рака простаты». Журнал стероидной биохимии и молекулярной биологии . 125 (1–2): 23–31. doi :10.1016/j.jsbmb.2010.11.005. PMC 3047603. PMID 21092758 .
- ^ ab Mega JL, Stitziel NO, Smith JG, Chasman DI, Caulfield M, Devlin JJ и др. (июнь 2015 г.). «Генетический риск, события ишемической болезни сердца и клиническая польза терапии статинами: анализ испытаний первичной и вторичной профилактики». Lancet . 385 (9984): 2264–2271. doi :10.1016/S0140-6736(14)61730-X. PMC 4608367 . PMID 25748612.
- ^ "CYP17A1 - Стероидная 17-альфа-гидроксилаза/17,20 лиаза - Homo sapiens (человек) - ген и белок CYP17A1". www.uniprot.org . Архивировано из оригинала 2016-10-12 . Получено 2016-10-11 .
- ^ Estrada DF, Laurence JS, Scott EE (февраль 2016 г.). «Взаимодействие цитохрома P450 17A1 с доменом FMN его редуктазы, охарактеризованное с помощью ЯМР». Журнал биологической химии . 291 (8): 3990–4003. doi : 10.1074/jbc.M115.677294 . PMC 4759177. PMID 26719338.
- ^ DeVore NM, Scott EE (январь 2012 г.). «Структуры цитохрома P450 17A1 с препаратами для лечения рака простаты абиратероном и TOK-001». Nature . 482 (7383): 116–119. Bibcode :2012Natur.482..116D. doi :10.1038/nature10743. PMC 3271139 . PMID 22266943.
- ^ Petrunak EM, DeVore NM, Porubsky PR, Scott EE (ноябрь 2014 г.). «Структуры человеческого стероидогенного цитохрома P450 17A1 с субстратами». Журнал биологической химии . 289 (47): 32952–32964. doi : 10.1074/jbc.M114.610998 . PMC 4239641. PMID 25301938 .
- ^ abc Сторбек К.Х., Сварт П., Африкандер Д., Конради Р., Лоу Р., Сварт AC (апрель 2011 г.). «16α-гидроксипрогестерон: происхождение, биосинтез и взаимодействие с рецепторами». Молекулярная и клеточная эндокринология . 336 (1–2): 92–101. doi : 10.1016/j.mce.2010.11.016. PMID 21095220. S2CID 5503049.
- ^ DeVore NM, Scott EE (январь 2012 г.). «Структуры цитохрома P450 17A1 с препаратами для лечения рака простаты абиратероном и TOK-001». Nature . 482 (7383): 116–119. Bibcode :2012Natur.482..116D. doi :10.1038/nature10743. PMC 3271139 . PMID 22266943.
- ^ Удхане СС, Дик Б., Ху К., Хартманн Р.В., Панди А.В. (сентябрь 2016 г.). «Специфичность ингибиторов CYP17A1 против рака простаты на биосинтез андрогенов». Связь с биохимическими и биофизическими исследованиями . 477 (4): 1005–1010. дои : 10.1016/j.bbrc.2016.07.019 . ПМИД 27395338.
- ^ Pandey AV, Miller WL (апрель 2005 г.). «Регулирование активности 17,20 лиазы цитохромом b5 и фосфорилированием серина P450c17». Журнал биологической химии . 280 (14): 13265–13271. doi : 10.1074/jbc.M414673200 . PMID 15687493.
- ^ ab Zhang LH, Rodriguez H, Ohno S, Miller WL (ноябрь 1995 г.). «Фосфорилирование серина человеческого P450c17 увеличивает активность 17,20-лиазы: последствия для адренархе и синдрома поликистозных яичников». Труды Национальной академии наук Соединенных Штатов Америки . 92 (23): 10619–10623. Bibcode : 1995PNAS...9210619Z. doi : 10.1073/pnas.92.23.10619 . PMC 40663. PMID 7479852 .
- ^ Фуками М., Хомма К., Хасегава Т., Огата Т. (апрель 2013 г.). «Задний путь биосинтеза дигидротестостерона: последствия для нормального и аномального развития пола человека». Динамика развития . 242 (4): 320–329. doi : 10.1002/dvdy.23892 . PMID 23073980. S2CID 44702659.
- ^ Масютин М, Ядав М (2023). «Альтернативные пути андрогенов». Викижурнал медицины . 10 : X. doi : 10.15347/WJM/2023.003 . S2CID 257943362.
- ^ "Entrez Gene: CYP17A1 цитохром P450, семейство 17, подсемейство A, полипептид 1". Архивировано из оригинала 2010-03-07 . Получено 2017-08-30 .
- ^ Ma YN, Cao CY, Wang QW, Gui WJ, Zhu GN (октябрь 2016 г.). «Влияние азоциклина на транскрипцию генов и стероидный метаболом гипоталамо-гипофизарно-гонадной оси и их последствия для воспроизводства у данио-рерио (Danio rerio)». Aquatic Toxicology . 179 : 55–64. doi :10.1016/j.aquatox.2016.08.006. PMID 27571716.
- ^ Legendre A, Elie C, Ramambason C, Manens L, Souidi M, Froment P, et al. (август 2016 г.). «Эндокринные эффекты пожизненного воздействия обедненного урана в малых дозах на функции яичек у взрослых крыс» (PDF) . Токсикология . 368–369: 58–68. Bibcode :2016Toxgy.368...58L. doi : 10.1016/j.tox.2016.08.014 . PMID 27544493. Архивировано (PDF) из оригинала 2024-02-02 . Получено 2024-02-02 .
- ^ Ядав Р., Петрунак Э.М., Эстрада Д.Ф., Скотт Э.Е. (февраль 2017 г.). «Структурное понимание функции стероидогенного цитохрома P450 17A1». Молекулярная и клеточная эндокринология . 441 : 68–75. doi :10.1016/j.mce.2016.08.035. PMC 5235955. PMID 27566228 .
- ^ Костин В.А., Золотцев В.А., Кузиков А.В., Масамрех Р.А., Шумянцева В.В., Веселовский А.В. и др. (ноябрь 2016 г.). «Оксазолинильные производные [17(20)E]-21-норпрегнена, различающиеся строением колец A и B. Легкий синтез и ингибирование каталитической активности CYP17A1». Стероиды . 115 : 114–122. doi : 10.1016/j.steroids.2016.06.002. PMID 27505042. S2CID 205256638.
- ^ ab Бономо С, Хансен ЧХ, Петрунак ЭМ, Скотт ЭЕ, Стайришаве Б, Йоргенсен ФС и др. (Июль 2016 г.). «Перспективные инструменты в исследовании рака простаты: селективные нестероидные ингибиторы цитохрома Р450 17А1». Scientific Reports . 6 : 29468. Bibcode :2016NatSR...629468B. doi :10.1038/srep29468. PMC 4942611 . PMID 27406023.
- ^ Acién P, Acién M (ноябрь 2020 г.). «Нарушения полового развития: классификация, обзор и влияние на фертильность». Журнал клинической медицины . 9 (11): 3555. doi : 10.3390/jcm9113555 . PMC 7694247. PMID 33158283 .
- ^ Bordeau BM, Ciulla DA, Callahan BP (сентябрь 2016 г.). «Hedgehog Proteins Consume Steroidal CYP17A1 Antagonists: Potential Therapeutic Value in Advanced Prostate Cancer». ChemMedChem . 11 (18): 1983–1986. doi :10.1002/cmdc.201600238. PMC 5588864 . PMID 27435344.
- ^ Fernández-Cancio M, Camats N, Flück CE, Zalewski A, Dick B, Frey BM и др. (апрель 2018 г.). «Механизм двойной активности человеческого CYP17A1 и связывания с препаратом против рака простаты абиратерон, выявленный новой мутацией V366M, вызывающей дефицит 17,20 лиазы». Pharmaceuticals . 11 (2): 37. doi : 10.3390/ph11020037 . PMC 6027421 . PMID 29710837.
- ^ PDB : 3ruk ; DeVore NM, Scott EE (январь 2012 г.). «Структуры цитохрома P450 17A1 с препаратами для лечения рака простаты абиратероном и TOK-001». Nature . 482 (7383): 116–119. Bibcode :2012Natur.482..116D. doi :10.1038/nature10743. PMC 3271139 . PMID 22266943.
- ^ «Реформулированный Галетерон от Tokai Pharmaceuticals демонстрирует устойчивое снижение ПСА у пациентов с прогрессирующим раком простаты» (пресс-релиз). Tokai Pharmaceuticals. 29 января 2014 г.[ постоянная мертвая ссылка ]
- ^ Bird IM, Abbott DH (октябрь 2016 г.). «Поиск селективного ингибитора 17,20 лиазы; извлечение уроков из природы». Журнал стероидной биохимии и молекулярной биологии . 163 : 136–146. doi : 10.1016/j.jsbmb.2016.04.021. PMC 5046225. PMID 27154414. VT464
— еще одно недавно разработанное соединение, предположительно действующее как селективный ингибитор лиазы, и в открытом доступе доступны более полные данные, подтверждающие это утверждение. Обзор опубликованных предварительных данных показывает, что IC50 для активности лиазы CYP17 человека в десять раз ниже, чем для гидроксилазы 15, и у нечеловеческих приматов VT464 был способен подавлять циркулирующий тестостерон так же эффективно, как абиратерон, но с минимально подавленным кортизолом (оставаясь на уровне 82% контроля по сравнению с всего лишь 9% с абератероном) и без сопутствующего увеличения прегненолона, прогестерона и минералокортикоидов, в противном случае наблюдавшегося при абиратероне. Как и Галатерон, VT464 также используется в клинических испытаниях без совместного введения преднизона. Вместе с явным отсутствием подавления циркулирующего кортизола у нечеловеческих приматов эти данные утверждают, что VT464 действительно может быть селективным ингибитором 17,20 лиазы.
- ^ Madan RA, Schmidt KT, Karzai F, Peer CJ, Cordes LM, Chau CH и др. (август 2020 г.). «Исследование фазы 2 севитеронела (INO-464) у пациентов с метастатическим кастрационно-резистентным раком простаты после лечения энзалутамидом». Clinical Genitourinary Cancer . 18 (4): 258–267.e1. doi :10.1016/j.clgc.2019.11.002. PMC 7415516 . PMID 32327394.
- ^ Peer CJ, Schmidt KT, Kindrick JD, Eisner JR, Brown VV, Baskin-Bey E и др. (октябрь 2019 г.). «Популяционный фармакокинетический анализ перорального ингибитора лиазы CYP17 и андрогеновых рецепторов севитеронела у пациентов с прогрессирующим/метастатическим кастрационно-резистентным раком предстательной железы или раком молочной железы». Cancer Chemotherapy and Pharmacology . 84 (4): 759–770. doi :10.1007/s00280-019-03908-0. PMC 8132106. PMID 31367790. S2CID 199056344 .
Дальнейшее чтение
- Miura K, Yasuda K, Yanase T, Yamakita N, Sasano H, Nawata H и др. (октябрь 1996 г.). «Мутация гена цитохрома P-45017 альфа (CYP17) у японского пациента, ранее зарегистрированного как имеющего гиперальдостеронизм, чувствительный к глюкокортикоидам: с обзором японских пациентов с мутациями CYP17». Журнал клинической эндокринологии и метаболизма . 81 (10): 3797–3801. doi : 10.1210/jcem.81.10.8855840 . PMID 8855840.
- Miller WL, Geller DH, Auchus RJ (1999). «Молекулярная основа дефицита изолированной 17,20 лиазы». Endocrine Research . 24 (3–4): 817–825. doi :10.3109/07435809809032692. PMID 9888582.
- Strauss JF (ноябрь 2003 г.). «Некоторые новые мысли о патофизиологии и генетике синдрома поликистозных яичников». Annals of the New York Academy of Sciences . 997 (1): 42–48. Bibcode : 2003NYASA.997...42S. doi : 10.1196/annals.1290.005. PMID 14644808. S2CID 23559461.
- Haider SM, Patel JS, Poojari CS, Neidle S (июль 2010 г.). «Молекулярное моделирование комплексов ингибиторов и динамики активного центра цитохрома P450 C17, мишени для терапии рака простаты». Журнал молекулярной биологии . 400 (5): 1078–1098. doi :10.1016/j.jmb.2010.05.069. PMID 20595043.
Внешние ссылки
- CYP17A1+белок,+человек в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
- Расположение генома человека CYP17A1 и страница с подробностями гена CYP17A1 в браузере генома UCSC .