Ауреусидинсинтаза
| Ауреусидинсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.21.3.6 | ||||||||
| Номер CAS | 320784-48-3 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Ауреусидинсинтаза ( EC 1.21.3.6, AmAS1 ) — фермент с систематическим названием 2',4,4',6'-тетрагидроксихалкон 4'-O-бета-D-глюкозид: кислородоксидоредуктаза . [1] [2] [3] [4]
Ауресидинсинтаза имеет две основные ферментативные задачи: гидроксилирование в 3-м положении на B-кольце халконов и окислительная циклизация халконов с образованием ауронов . [2] Модифицированные халконы обычно представляют собой глюкозилированный 2',4,4',6'-тетрагидроксихалкон (ТГК) и 2',3,4,4',6'-пентагидроксихалкон (ПГК). [2] Эти ауроны, в частности ауресидин, образуют пигменты для окраски цветов. [1] Эти пигменты, возможно, были разработаны для привлечения и направления пчел для опыления , [5] но они также обеспечивают защиту от вирусов , вредителей и грибков . [6]
Структура фермента
Ауреусидинсинтаза представляет собой мономерный гликопротеин массой 39 кДа, содержащий двуядерную медь . [1] Добавление фенилтиомочевины , которая конкурентно связывается с двуядерной медью, [7] подавляет общую производительность фермента. [2] В связи с этим вполне вероятно, что активный центр содержит двуядерную медь.
Ауреусидинсинтаза гомологична растительной полифенолоксидазе (PPO), [1], но содержит некоторые существенные модификации. В то время как PPO имеет высококонсервативную N-концевую аминокислотную последовательность для облегчения транспортировки в пластидный просвет, ауреусидинсинтаза лишена этой последовательности [1] и, таким образом, не локализуется в плазмиде. Подобно PPO, [8] ауреусидинсинтаза, вероятно, сначала синтезируется как более крупный белок ~60 кДа, а затем подвергается протеолитическому расщеплению для удаления транспортных групп. [1]
Механизм фермента
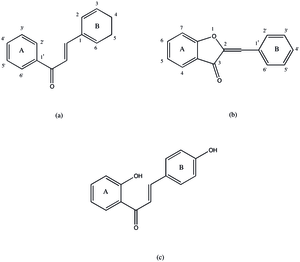
Ауреусидинсинтаза катализирует образование ауронов из халконов через гидроксилирование и окислительную циклизацию. Этот класс реакций включает:
- (1) 2',4,4',6'-тетрагидроксихалкон 4'-O-бета-D-глюкозид + O 2 ауреусидин 6-O-бета-D-глюкозид + H 2 O
- (2) 2',3,4,4',6'-пентагидроксихалкон 4'-O-бета-D-глюкозид + 1/2 O 2 ауреусидин 6-O-бета-D-глюкозид + H 2 O
- (3) 2',3,4,4',6'-пентагидроксихалкон 4'-О-бета-D-глюкозид + О 2 брактеатин 6-О-бета-D-глюкозид + H 2 O
Хотя белок назван в честь желтого пигмента ауреусидина, который он часто производит, он может производить ряд подобных ауронов, включая сульфуретин, брактеатин и 3',4',5',6-тетрагидроксиаурон. Чтобы модифицировать халкон в аурон, халкон должен подвергнуться окислительной циклизации с образованием пятичленного гетероцикла , слитого с a-кольцом аурона. Этот шаг может не произойти, если 3-е положение на B-кольце халкона не будет оксигенировано. Из этого и гомологии белка с PPO, текущий предлагаемый механизм для ауреусидинсинтазы показан на рис. 2. Первый шаг в процессе приводит к гидроксилированию в 3-м положении (для ТГК) и окислению до дикетонового кольца. Этот механизм, как правило, считается таким же, как и у тирозиназы . [9] Это предположение основано на гомологии двух структур и схожей функциональности. Этот продукт затем подвергается окислительной циклизации, а затем изомеризации , давая конечный продукт, но возможно, что эти этапы происходят вне фермента . [2] Этот механизм может производить только ауроны с 3',4'-дигидрокси или 3',4',5'-тригидрокси функционализацией, но были зарегистрированы ауроны с одной или без гидроксильной группы на B-кольце. Неясно, является ли это образование аурона следствием альтернативного механизма или другого белка. [10]

Биологическая функция
Ауреусидин — это растительный флавоноид , который обеспечивает желтую окраску нескольких растений, включая львиный зев и космос. [1] Он также обеспечивает различные защитные преимущества от болезней и паразитов. [6] Ауресидинсинтаза активна только в вакуоли и транспортируется непосредственно из эндоплазматического ретикулума в вакуоль через аппарат Гольджи. [4] Исследования in vitro показали, что синтез аурона происходит намного быстрее, когда халкон сначала глюкозилируется, [2] а исследования in vivo показали, что желтая окраска не выражается без коэкспрессии UDP-глюкуронозилтрансферазы UGT88D3 для первого глюкозилирования халкона. [4] Это глюкозилирование способствует производству аурона путем метаболического направления модифицированных халконов в вакуоль. [11]
Промышленная значимость
Генетическая модификация цветковых растений для выражения цветов, которые невозможны путем естественного разведения, была одной из основных целей цветоводческой промышленности . [12] Ауреусидинсинтаза была введена в растения с естественно синими цветами для формирования новых трансгенных желтых цветов у видов Torenia . [4] Это достигается путем совместной экспрессии ауреусидинсинтазы и UDP-глюкоза: халкон 4'-O-глюкозилтрансферазы в цветах и использования РНК-интерференции для блокирования экспрессии естественной выработки пигмента . [4]
Помимо своей важности для цветоводческой отрасли, ауреусидинсинтаза является относительно новой целью для биомедицинских исследований. [13] Было обнаружено, что ауроны обладают антиоксидантным , антибактериальным и противораковым действием. [14] Ауреусидинсинтаза особенно привлекательна для создания генетически модифицированных растений, которые могут обладать лечебными свойствами, и уже было продемонстрировано создание трансгенных листьев салата и табака с улучшенными антиоксидантными свойствами. [15]
Ссылки
- ^ abcdefg Накаяма Т, Ёнекура-Сакакибара К, Сато Т, Кикучи С, Фукуи Ю, Фукучи-Мизутани М, Уэда Т, Накао М, Танака Ю, Кусуми Т, Нисино Т (ноябрь 2000 г.). «Ауреусидинсинтаза: гомолог полифенолоксидазы, ответственный за окраску цветов». Наука . 290 (5494): 1163–6. Бибкод : 2000Sci...290.1163N. дои : 10.1126/science.290.5494.1163. ПМИД 11073455.
- ^ abcdef Nakayama T, Sato T, Fukui Y, Yonekura-Sakakibara K, Hayashi H, Tanaka Y, Kusumi T, Nishino T (июнь 2001 г.). "Анализ специфичности и механизм синтеза аурона, катализируемого ауреусидинсинтазой, гомологом полифенолоксидазы, ответственным за окраску цветков". FEBS Letters . 499 (1–2): 107–11. doi : 10.1016/S0014-5793(01)02529-7 . PMID 11418122.
- ^ Сато Т., Накаяма Т., Кикучи С., Фукуи Ю., Ёнекура-Сакакибара К., Уэда Т., Нишино Т., Танака Ю., Кусуми Т. (январь 2001 г.). «Ферментативное образование ауронов в экстрактах цветков львиного зева желтого». Наука о растениях . 160 (2): 229–236. дои : 10.1016/s0168-9452(00)00385-x. ПМИД 11164594.
- ^ abcde Оно Э, Фукучи-Мизутани М, Накамура Н, Фукуи Ю, Ёнекура-Сакакибара К, Ямагути М, Накаяма Т, Танака Т, Кусуми Т, Танака Ю (июль 2006 г.). «Желтые цветы, возникающие в результате экспрессии пути биосинтеза аурона». Труды Национальной академии наук Соединенных Штатов Америки . 103 (29): 11075–80. Бибкод : 2006PNAS..10311075O. дои : 10.1073/pnas.0604246103 . ПМК 1544175 . ПМИД 16832053.
- ^ Лунау К, Вахт С, Читтка Л (1996). «Выбор цвета наивными шмелями и его влияние на восприятие цвета». Журнал сравнительной физиологии A. 178 ( 4). doi :10.1007/BF00190178. S2CID 21435915.
- ^ ab Boumendjel A (декабрь 2003 г.). «Ауроны: подкласс флавонов с многообещающим биологическим потенциалом». Current Medicinal Chemistry . 10 (23): 2621–30. doi :10.2174/0929867033456468. PMID 14529476.
- ^ Klabunde T, Eicken C, Sacchettini JC, Krebs B (декабрь 1998 г.). «Кристаллическая структура растительной катехолоксидазы, содержащей димедный центр». Nature Structural Biology . 5 (12): 1084–90. doi :10.1038/4193. PMID 9846879. S2CID 29946865.
- ^ Робинсон СП, Драй И (май 1992). «Полифенолоксидаза листьев конских бобов — это белок массой 60 килодальтон, подверженный протеолитическому расщеплению». Физиология растений . 99 (1): 317–323. doi :10.1104/pp.99.1.317. PMC 1080442. PMID 16668868 .
- ^ Санчес-Феррер А, Родригес-Лопес Х.Н., Гарсиа-Кановас Ф, Гарсиа-Кармона Ф (февраль 1995 г.). «Тирозиназа: всесторонний обзор ее механизма». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1247 (1): 1–11. дои : 10.1016/0167-4838(94)00204-т. ПМИД 7873577.
- ^ Rathmell WG, Bendall DS (март 1972). «Окисление халкона, катализируемое пероксидазой, и его возможное физиологическое значение». The Biochemical Journal . 127 (1): 125–32. doi :10.1042/bj1270125. PMC 1178567. PMID 5073737 .
- ^ Jørgensen K, Rasmussen AV, Morant M, Nielsen AH, Bjarnholt N, Zagrobelny M, Bak S, Møller BL (июнь 2005 г.). «Образование метаболона и метаболическое каналирование в биосинтезе натуральных растительных продуктов». Current Opinion in Plant Biology . 8 (3): 280–91. doi :10.1016/j.pbi.2005.03.014. PMID 15860425.
- ^ Mol J, Cornish E, Mason J, Koes R (1999). «Цветы нового цвета». Current Opinion in Biotechnology . 10 (2): 198–201. doi :10.1016/S0958-1669(99)80035-4. PMID 10209139.
- ^ Haudecoeur R, Boumendjel A (2012). «Последние достижения в медицинской химии ауронов». Current Medicinal Chemistry . 19 (18): 2861–75. doi :10.2174/092986712800672085. PMID 22519399.
- ^ Detsi A, Majdalani M, Kontogiorgis CA, Hadjipavlou-Litina D, Kefalas P (декабрь 2009 г.). «Природные и синтетические 2'-гидрокси-халконы и ауроны: синтез, характеристика и оценка антиоксидантной и ингибирующей активности соевой липоксигеназы». Bioorganic & Medicinal Chemistry . 17 (23): 8073–85. doi :10.1016/j.bmc.2009.10.002. PMID 19853459.
- ^ Shakya R, Ye J, Rommens CM (декабрь 2012 г.). «Измененный цвет листьев связан с повышенной активностью супероксидного захвата в трансгенных растениях, продуцирующих ауреусидин». Plant Biotechnology Journal . 10 (9): 1046–55. doi : 10.1111/j.1467-7652.2012.00732.x . PMID 22924954.
Внешние ссылки
- Ауреусидин+синтаза в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)

