альфа-2-макроглобулин
| А2М | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | A2M , A2MD, CPAMD5, FWP007, S863-7, транскупреин, альфа-2-макроглобулин | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 103950; МГИ : 2449119; гомологен : 37248; Генные карты : A2M; ОМА :А2М - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
α 2 -Макроглобулин ( α 2 M ) или альфа-2-макроглобулин — это большой (720 кДа) плазменный белок, содержащийся в крови . Он в основном вырабатывается печенью , а также локально синтезируется макрофагами , фибробластами и адренокортикальными клетками . У человека он кодируется геном A2M .
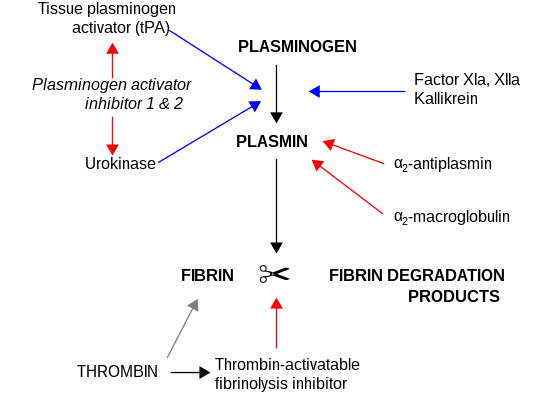
α 2 -макроглобулин действует как антипротеаза и способен инактивировать огромное количество протеиназ. Он действует как ингибитор фибринолиза, ингибируя плазмин и калликреин . Он действует как ингибитор коагуляции, ингибируя тромбин . α 2 -макроглобулин может действовать как белок-носитель, поскольку он также связывается с многочисленными факторами роста и цитокинами, такими как тромбоцитарный фактор роста, основной фактор роста фибробластов, TGF-β, инсулин и IL-1β.
Не было выявлено никакого специфического дефицита с сопутствующим заболеванием, и ни одно болезненное состояние не приписывается низким концентрациям α 2 -макроглобулина. Концентрация α 2 -макроглобулина возрастает в 10 раз и более при нефротическом синдроме, когда другие низкомолекулярные белки теряются в моче. Потеря α 2 -макроглобулина в мочу предотвращается его большим размером. Конечным результатом является то, что α 2 -макроглобулин достигает уровней сыворотки, равных или превышающих уровни альбумина при нефротическом синдроме, что имеет эффект поддержания онкотического давления .
Структура
Человеческий α 2 -макроглобулин состоит из четырех идентичных субъединиц, соединенных вместе связями -SS- . [5] [6] В дополнение к тетрамерным формам α 2 -макроглобулина были идентифицированы димерные , а позднее и мономерные ингибиторы αM-протеазы. [7] [8]
Каждый мономер человеческого α 2 -макроглобулина состоит из нескольких функциональных доменов, включая домены макроглобулина, домен, содержащий тиоловый эфир, и домен, связывающий рецептор. [9] В целом, α 2 -макроглобулин является крупнейшим основным неиммуноглобулиновым белком в плазме человека.
Было показано, что аминокислотная последовательность α2 - макроглобулина на 71% совпадает с аминокислотной последовательностью белка зоны беременности (PZP; также известного как связанный с беременностью α2 - гликопротеин). [10]
Функция
Семейство белков α-макроглобулина (αM) включает ингибиторы протеазы [11], типичным представителем которых является человеческий тетрамерный α 2 -макроглобулин (α 2 M); они принадлежат к семейству ингибиторов протеиназы MEROPS I39, клан IL. Эти ингибиторы протеазы обладают несколькими определяющими свойствами, в том числе (1) способностью ингибировать протеазы всех каталитических классов, (2) наличием «области приманки» (также известной как последовательность аминокислот в молекуле α 2 -макроглобулина или гомологичного белка, которая содержит разрезаемые пептидные связи для тех протеиназ, которые она ингибирует) и тиолового эфира, (3) аналогичным механизмом ингибирования протеазы и (4) инактивацией ингибирующей способности путем реакции тиолового эфира с небольшими первичными аминами . Ингибиторы протеазы αM ингибируют стерическими препятствиями. [12] Механизм включает расщепление протеазой области приманки, сегмента αM, который особенно восприимчив к протеолитическому расщеплению, которое инициирует конформационное изменение , так что αM разрушается вокруг протеазы. В полученном комплексе αM-протеаза активный сайт протеазы стерически экранирован, таким образом существенно уменьшая доступ к белковым субстратам . Два дополнительных события происходят в результате расщепления области приманки, а именно (1) h-цистеинил-g-глутамил тиоловый эфир становится высокореактивным и (2) крупное конформационное изменение обнажает консервативный домен связывания COOH-терминала рецептора [13] (RBD). Воздействие RBD позволяет комплексу αM-протеазы связываться с рецепторами клиренса и удаляться из циркуляции. [14] Были идентифицированы тетрамерные, димерные и, совсем недавно, мономерные ингибиторы αM-протеазы. [7] [8]
α 2 -Макроглобулин способен инактивировать огромное количество протеиназ (включая сериновые , цистеиновые , аспарагиновые и металлопротеиназы ). Он действует как ингибитор фибринолиза , ингибируя плазмин и калликреин. Он действует как ингибитор коагуляции , ингибируя тромбин . [15] α 2 -Макроглобулин имеет в своей структуре область «приманки» из 35 аминокислот. Протеиназы, связывающиеся и расщепляющие область приманки, становятся связанными с α 2 M. Комплекс протеиназа–α 2 M распознается рецепторами макрофагов и выводится из системы.
Известно, что α 2 -макроглобулин связывает цинк , а также медь в плазме, даже сильнее, чем альбумин, и поэтому его также называют транскупреином . [16] От 10 до 15% меди в плазме человека хелатируется α 2 -макроглобулином. [17]
Болезнь
Уровень α 2 -макроглобулина повышается, когда уровень сывороточного альбумина низкий, [18] , что чаще всего наблюдается при нефротическом синдроме , состоянии, при котором почки начинают выводить некоторые из более мелких белков крови. Из-за своего размера α 2 -макроглобулин задерживается в кровотоке. Увеличение продукции всех белков означает, что концентрация α 2 -макроглобулина увеличивается. Это увеличение не оказывает существенного неблагоприятного воздействия на здоровье, но используется в качестве диагностического признака.
Увеличение α2 - макроглобулина при нормальном количестве альбумина в основном указывает на острое и/или хроническое воспаление. [19]
Распространенный вариант (29,5%) ( полиморфизм ) α2 - макроглобулина приводит к повышенному риску болезни Альцгеймера . [20] [21]
α2 - макроглобулин связывается с активными формами желатиназы ( ММП -2 и ММП-9 ) и удаляет их из кровотока через рецепторы-мусорщики на фагоцитах.
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000175899 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000030111 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Andersen GR, Koch TJ, Dolmer K, Sottrup-Jensen L, Nyborg J (октябрь 1995 г.). "Рентгеновская структура альфа-2-макроглобулина человека, обработанного метиламином, с низким разрешением". J. Biol. Chem . 270 (42): 25133–41. doi : 10.1074/jbc.270.42.25133 . PMID 7559647. S2CID 86387917.
- ^ Соттруп-Йенсен Л., Степаник Т.М., Кристенсен Т., Вежбицки Д.М., Джонс К.М., Лёнблад П.Б. и др. (1984). «Первичная структура альфа-2-макроглобулина человека. V. Полная структура». J Биол Хим . 259 (13): 8318–27. дои : 10.1016/S0021-9258(17)39730-2 . ПМИД 6203908.
- ^ ab Dodds AW, Law SK (декабрь 1998 г.). «Филогения и эволюция белков C3, C4 и альфа-2-макроглобулина, содержащих тиоэфирную связь». Immunol. Rev. 166 : 15–26. doi :10.1111/j.1600-065X.1998.tb01249.x. PMID 9914899. S2CID 84262599.
- ^ ab Armstrong PB, Quigley JP (1999). «Альфа2-макроглобулин: эволюционно консервативная часть врожденной иммунной системы». Dev. Comp. Immunol . 23 (4–5): 375–90. doi :10.1016/s0145-305x(99)00018-x. PMID 10426429.
- ^ Doan N, Gettins PG (2007). «Человеческий альфа2-макроглобулин состоит из нескольких доменов, как и предсказывает гомология с компонентом комплемента C3». Biochem J . 407 (1): 23–30. doi :10.1042/BJ20070764. PMC 2267405 . PMID 17608619.
- ^ Devriendt K, Van den Berghe H, Cassiman JJ, Marynen P (1991). "Первичная структура белка зоны беременности. Молекулярное клонирование полноразмерного клона PZP cDNA с помощью полимеразной цепной реакции". Biochimica et Biophysica Acta (BBA) - Структура и экспрессия генов . 1088 (1): 95–103. doi :10.1016/0167-4781(91)90157-h. PMID 1989698.
- ^ Sottrup-Jensen L (июль 1989). «Альфа-макроглобулин: структура, форма и механизм образования протеиназного комплекса». J. Biol. Chem . 264 (20): 11539–42. doi : 10.1016/S0021-9258(18)80094-1 . PMID 2473064.
- ^ Enghild JJ, Salvesen G, Thøgersen IB, Pizzo SV (июль 1989). «Связывание и ингибирование протеиназы мономерным альфа-макроглобулином крысы альфа 1-ингибитором-3». J. Biol. Chem . 264 (19): 11428–35. doi : 10.1016/S0021-9258(18)60482-X . PMID 2472396.
- ^ Энгильд Дж. Дж., Тёгерсен И.Б., Рош П.А., Пиццо С.В. (февраль 1989 г.). «Консервативная область альфа-макроглобулинов участвует в связывании с рецептором альфа-макроглобулина млекопитающих». Биохимия . 28 (3): 1406–12. дои : 10.1021/bi00429a069. ПМИД 2469470.
- ^ Van Leuven F, Cassiman JJ, Van den Berghe H (декабрь 1986 г.). «Белок зоны беременности человека и альфа-2-макроглобулин. Высокоаффинное связывание комплексов с одним и тем же рецептором на фибробластах и характеристика моноклональными антителами». J. Biol. Chem . 261 (35): 16622–5. doi : 10.1016/S0021-9258(18)66612-8 . PMID 2430968.
- ^ de Boer JP, Creasey AA, Chang A, Abbink JJ, Roem D, Eerenberg AJ, Hack CE, Taylor FB (декабрь 1993 г.). «Альфа-2-макроглобулин действует как ингибитор фибринолитических, свертывающих и нейтрофильных протеиназ при сепсисе: исследования с использованием модели бабуина». Infect . Immun . 61 (12): 5035–43. doi :10.1128/iai.61.12.5035-5043.1993. PMC 281280. PMID 7693593.
- ^ Лю Н, Ло Л.С., Аскари Ш., Джонс Л., Кидане Т.З., Нгуен Т.Т., Гофорт Дж., Чу Ю.Х., Вивас Э., Цай М., Вестбрук Т., Линдер MC (сентябрь 2007 г.). «Транкупреин - это макроглобулин, регулируемый наличием меди и железа». Журнал пищевой биохимии . 18 (9): 597–608. doi :10.1016/j.jnutbio.2006.11.005. ПМЦ 4286573 . ПМИД 17363239.
- ^ Liu Nm, Nguyen T, Kidane T, Moriya M, Goforth J, Chu A, Linder M (6 марта 2006 г.). «Транскупреины являются сывороточными переносчиками меди из семейства макроглобулинов и могут регулироваться железом и медью». The FASEB Journal . 20 (4): A553–A554. doi : 10.1096/fasebj.20.4.A553-d . ISSN 0892-6638. S2CID 90794136.
- ^ Stevenson FT, Greene S, Kaysen GA (январь 1998). «Концентрации сывороточного альфа-2-макроглобулина и альфа-1-ингибитора 3 увеличиваются при гипоальбуминемии за счет посттранскрипционных механизмов». Kidney International . 53 (1): 67–75. doi : 10.1046/j.1523-1755.1998.00734.x . PMID 9453001.
- ^ "Электрофорез белков - сыворотка". Медицинская школа Айкана в Маунт-Синай .Последний просмотр: 25.01.2022 г. Проверено: Тоддом Герстеном, доктором медицины, и Дэвидом Зивом, доктором медицины
- ^ Blacker D, Wilcox MA, Laird NM, Rodes L, Horvath SM, Go RC, Perry R, Watson B, Bassett SS, McInnis MG, Albert MS, Hyman BT, Tanzi RE (август 1998 г.). «Альфа-2-макроглобулин генетически связан с болезнью Альцгеймера». Nat. Genet . 19 (4): 357–60. doi :10.1038/1243. PMID 9697696. S2CID 15628847.
- ^ Kovacs DM (июль 2000 г.). «альфа2-макроглобулин при позднем начале болезни Альцгеймера». Exp. Gerontol . 35 (4): 473–9. doi :10.1016/S0531-5565(00)00113-3. PMID 10959035. S2CID 54409507.
- Макферсон и Пинкус: Клиническая диагностика и лечение лабораторными методами Генри, 21-е изд.
- Файрстайн: Учебник ревматологии Келли, 8-е издание.
Внешние ссылки
- Онлайн- база данных MEROPS для пептидаз и их ингибиторов: I39.001 [ постоянная неработающая ссылка ]
- альфа+2-макроглобулин в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
- Расположение гена человека A2M в браузере генома UCSC .
- Подробная информация о гене человека A2M в браузере генома UCSC .





