Александр Дианин
Александр Дианин | |
|---|---|
 | |
| Рожденный | ( 1851-04-20 )20 апреля 1851 г. |
| Умер | 6 декабря 1918 г. (1918-12-06)(67 лет) |
| Национальность | Русский |
| Альма-матер | Йенский университет ( доктор химических наук, 1877) Императорская медико-хирургическая академия в Санкт-Петербурге ( доктор медицины , 1882) |
| Известный | Бисфенол А Дианин соединение |
| Научная карьера | |
| Поля | Органическая химия |
| Учреждения | Императорская Медико-хирургическая Академия в Санкт-Петербурге |
Александр Павлович Дианин ( русский : Александр Павлович Дианин ; 20 апреля 1851 — 6 декабря 1918) был химиком Российской империи из Санкт-Петербурга . Он проводил исследования фенолов и открыл производное фенола, ныне известное как бисфенол А [1] [2] и соответственно названное соединение Дианина . [3] Он был женат на приемной дочери своего коллеги-химика Александра Бородина . В 1887 году Дианин стал преемником своего тестя на посту заведующего кафедрой химии в Императорской медико-хирургической академии в Санкт-Петербурге (ныне Военно-медицинская академия имени С. М. Кирова ).
Бисфенол А и соединение Дианина
Метод Дианина для получения бисфенола А с 1891 года [1] остается наиболее широко известным подходом к этому важному соединению, [4] хотя метод был усовершенствован для промышленного синтеза. [5] Он включает в себя каталитическую конденсацию смеси фенола и ацетона 2:1 в присутствии концентрированной соляной кислоты или серной кислоты . Реакция легко протекает при комнатной температуре, производя сырой продукт, содержащий большое количество побочных продуктов (включая соединение Дианина ) в течение нескольких часов. [4] Общее уравнение простое, с водой в качестве единственного побочного продукта :
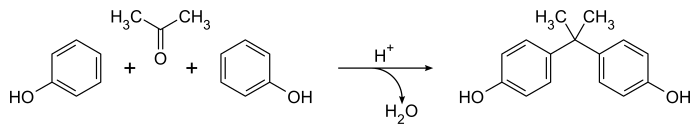
Механически кислотный катализатор преобразует ацетон в ион карбения , который подвергается реакции электрофильного ароматического замещения с фенолом, производя преимущественно пара -замещенные продукты. Второй вид карбения получается путем протонирования и потери алифатической гидроксильной группы, что приводит к бисфенолу А (4,4'-изопропилидендифенолу) после второй реакции ароматического замещения. Процесс не очень селективен, и известно большое количество второстепенных продуктов и побочных реакций. [4]

Побочные продукты, которые являются изомерами бисфенола А, возникают в результате образования орто -замещенных продуктов и включают 2,2'- и 2,4'-изомеры изопропилидендифенола. Другие побочные реакции включают образование трифенола I, 4,4'-(4-гидрокси- м -фенилендиизопропилиден)дифенола, при атаке электрофила карбения на молекулу бисфенола А и образование трифенола II, 4,4',4''-(2-метил-2-пентанил-4-илиден)трифенола, когда реакция элиминирования превращает карбений в реактивный олефин . [4] Катализируемая димеризация ацетона через альдольную конденсацию хорошо известна и дает диацетоновый спирт и (путем дегидратации ) оксид мезитила как в кислых [6], так и в основных условиях. [7] [8] Образование оксида мезитила in situ добавляет в смесь еще один реактивный олефин. В случаях, когда олефиновый фрагмент может взаимодействовать с фенольной гидроксильной группой (обычно в результате орто -замещения), происходят быстрые реакции циклизации , производящие флаваны и хроманы . [4] Это источник соединения Дианина в смеси, и Дианин впоследствии продемонстрировал, что соединение может быть получено с гораздо большим выходом путем прямой реакции фенола с оксидом мезитила. [3] Более поздние работы показали, что производство бисфенола А можно сделать гораздо более селективным, используя реакционную смесь со значительным избытком фенола, а не стехиометрический состав 2:1, что значительно подавляет побочные реакции. [5]
Ссылки
- ^ аб Дианин, AP (1891). «О продуктах конденсации кетонов с фенолами». Журнал Русского физико-химического общества (J. Russ. Phys. Chem. Soc.) (на русском языке). 23 : 488–517, 523–546, 601–611.
- ^ Цинке, Теодор (1905). «Ueber die Einwirkung von Brom und von Chlor auf Phenole: Substitutionsprodukte, псевдобромид и псевдохлорид» [О влиянии брома и хлора на фенолы: продукты замещения, псевдобромиды и псевдохлориды]. Юстус Либигс Annalen der Chemie (на немецком языке). 343 : 75–99. дои : 10.1002/jlac.19053430106.
- ^ аб Дианин, AP (1914). «Конденсация фенола с ненасыщенными кетонами. Конденсация фенола с мезитилоксидом». Журнал Русского физико-химического общества (J. Russ. Phys. Chem. Soc.) (на русском языке). 36 : 1310–1319.
- ^ abcde McKetta, John J. , ред. (1977). "Бисфенол А". Асфальтовая эмульсия для смешивания . Энциклопедия химической обработки и проектирования . Том 4. Марсель Деккер . С. 406–430. ISBN 9780824724542.
- ^ аб Файге, Гельмут; Фогес, Хайнц-Вернер; Хамамото, Тошиказу; Умемура, Сумио; Ивата, Тадао; Мики, Хисая; Фудзита, Ясухиро; Буйш, Ханс-Йозеф; Гарбе, Доротея; Паулюс, Вильфрид (2000). «Производные фенола». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a19_313. ISBN 3527306730.
- ^ Weissermel, Klaus; Arpe, Hans-Jürgen (2003). «Вторичные продукты ацетона». Industrial Organic Chemistry (4-е изд.). John Wiley & Sons . стр. 281–288. ISBN 9783527305780.
- ^ Конант, Джеймс Б .; Таттл, Нил (1921). "Диацетоновый спирт (2-пентан, 4-гидрокси-4-метил)". Org. Synth. 1 : 45. doi :10.15227/orgsyn.001.0045 ; Сборник , т. 1, стр. 199.
- ^ Конант, Джеймс Б .; Таттл, Нил (1921). "Оксид мезитила". Org. Synth. 1 : 53. doi :10.15227/orgsyn.001.0053 ; Сборник , т. 1, стр. 345.
Дальнейшее чтение
- Дианин, Сергей Александрович (1980). Бородин . Вестпорт: Greenwood Press . ISBN 9780313225291. OCLC 247826062.
- Фигуровский Николай Александрович; Соловьев, Юрий Иванович (1988). Александр Порфирьевич Бородин: биография химика . Нью-Йорк: Springer-Verlag. п. 22. ISBN 9780387178882. OCLC 16647830.