Актинин
Актинин — это микрофиламентный белок. Функциональный белок представляет собой антипараллельный димер , который сшивает тонкие нити в соседних саркомерах и, следовательно, координирует сокращения между саркомерами по горизонтальной оси. Альфа-актинин является частью суперсемейства спектрина . Это суперсемейство состоит из спектрина, дистрофина и их гомологичных и изоформ. В немышечных клетках он находится в актиновых нитях и в местах адгезии [1] . Решетчатое расположение обеспечивает стабильность сократительного аппарата мышц. [1] В частности, он помогает связывать актиновые нити с клеточной мембраной. [2] На каждом конце стержня и с пучками актиновых нитей имеется сайт связывания. [1]
Несаркомерные альфа-актинины, кодируемые ACTN1 и ACTN4 , широко экспрессируются. Экспрессия ACTN2 обнаружена как в сердечной , так и в скелетной мышце, тогда как ACTN3 ограничена последней. Оба конца палочковидного димера альфа-актинина содержат актин-связывающие домены. Шесть различных белков производятся из четырех генов, кодирующих альфа-актинин. Эти шесть белков можно далее разделить на две различные группы: мышечные (нечувствительные к кальцию) и немышечные цитоскелетные (чувствительные к кальцию) изоформы. [1]
Эволюция
Существует мнение, что существует общий ген-предок, подобный альфа-актинину, при рассмотрении особенностей альфа-актинина и спектрина. [3] Изучение последовательностей повторов спектрина дает доказательства двухэтапной модели, описывающей эволюцию суперсемейства спектринов. При рассмотрении их общего предка, альфа-актинин и спектрин имеют четыре гомологичных повтора. [3] Дупликация гена привела к появлению стабильной линии, которая привела к современным генам альфа-актинина. Одновременно другой дуплицированный ген приобрел дополнительные повторы через серию неравных событий кроссинговера. Это сделало субъединицу спектрина предком, которая является антипараллельным гомодимером, который может сшивать актиновые нити. [3] Альфа-актинин 1 (ACTN1) был открыт сорок лет назад из-за того, что он присутствовал в сократительном аппарате поперечно-полосатых мышц в больших количествах. [4] Альфа-актинин-1 необходим для прикрепления актиновых миофиламентов к Z-линиям в клетках скелетных мышц , [5] и к плотным тельцам в клетках гладких мышц . [6] Альфа-актинин 2 (ACTN2) в основном обнаруживается в сердечных и окислительных мышечных волокнах. Часть ACTN2 обнаруживается в мозге. Альфа-актинин 3 (ACTN3) обычно обнаруживается в мышечных волокнах типа II, обычно известных как быстро сокращающиеся мышечные волокна. [4]
Структура
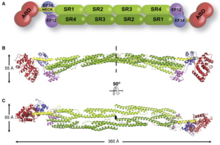
Он имеет N-конец, который есть у всех членов суперсемейства. Он состоит из двух последовательных гомологий кальпонина (CH), где спектриновые повторы идут сразу после него. Это позволяет определить длину и гибкость актин-связывающего белка. Сшивки актин-филамент включают альфа-актинин, который является функциональным антипараллельным димером. [1] Он состоит из актин-связывающего домена (ABD), соединенного с четырьмя спектриновыми повторами, образующими центральный стержень через гибкую область шейки. Эти повторы представляют собой 122 аминокислотных повтора. [8] Затем следует C-концевой кальмодулин (CaM)-подобный домен, который содержит два EF-hand кальций-связывающих мотива. [8] [1] Это формирует сайт связывания на каждом конце белка, что приводит к образованию стержнеобразной молекулы с пучками актиновых нитей. [1] Стержнеобразный вид обусловлен тем, что область SR имеет цилиндрическую форму. [7] На каждом конце находится функциональный домен (ABD и CaM). [1] Связывание кальция присутствует только в ACTN1 и ACTN4, тогда как ACTN2 и ACTN3 утратили способность связывать кальций. [9]
Актин-связывающий домен
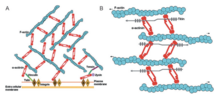
Альфа-актинин и актин являются высококонсервативными белками, причем альфа-актинин является наиболее консервативным во всем домене в семействе белков. Это связано с ABD, который связывается с доменами CH типа 1 и типа 2 (CH1 и CH2). Домен CH1-CH2 имеет гидрофильную стабилизирующую часть и гидрофобную часть. Ядро каждого домена CH имеет четыре спирали (A, C, E и G). Спирали C и G параллельны друг другу, а N-концевые спирали A и E окружают их. У людей кристаллические структуры ABD были определены для альфа-актинина 1,3 и 4. [1] ABD образует закрытую конформацию. ЯМР показал, что существует три основных ABD. Три сайта — это N-конец спирали A CH1, C-конец спирали G CH1 и междоменный линкер, граничащий с N-концевым сегментом домена CH2. [1] Они имеют высокое сродство к актиновым филаментам. Однако они должны работать вместе, чтобы иметь самое высокое сродство, поскольку CH2 не может связывать актиновые филаменты. При этом домен связывания актина расположен в N-концевой области молекулы альфа-актинина. [8]
Метаболизм
Альфа-актинин 3 (ACTN3) дефицитен примерно у шестнадцати процентов людей и играет важную роль в мышечном метаболизме. [10] Этот дефицит обусловлен преждевременным полиморфизмом стоп-кодона (R577X). [11] Ген R577X был выше у выносливых спортсменов, чем у спринтеров. [12] Среди четырех альфа-актининов млекопитающих ACTN3 выделяется как наиболее высокоспециализированный, в первую очередь экспрессируемый в быстрых гликолитических волокнах скелетных мышц. [11] У людей, у которых есть ACTN3, ученые наблюдали лучшие результаты в спринте и силовых показателях у спортсменов и населения в целом. [10] Несмотря на то, что это было обнаружено, недавний положительный отбор, по-видимому, повлиял на нулевой генотип XX, возможно, из-за его новой роли в регуляции мышечного метаболизма, как предполагают имеющиеся доказательства. [10] Отсутствие ACTN3 приводит к более окислительным путям использования энергии, поскольку активность гликогенфосфорилазы снижается. Отсутствие ACTN3 не приводит к явной причине мышечного заболевания [10], но наблюдалось изменение мышечной функции. [12]
Рак
Альфа-актинин 4 (ACTN4) экспрессируется в немышечных клетках. Он важен, так как является связующим звеном между двумя компонентами опухоли. ACTN4 направляет связь между актиновым цитоскелетом внутри клетки и интегринами, которые напрямую взаимодействуют со стромальным ECM. Кроме того, он может ощущать и реагировать на приложенную извне силу. [9] Этот процесс имеет решающее значение для формирования и продолжения рака молочной железы, колоректального рака, рака яичников и рака поджелудочной железы. Объяснение того, почему ACTN4 способствует формированию рака, до сих пор неизвестно. В клетках меланомного рака ACTN4 играет роль в клеточной морфологии. Он изменяет клетку из более мезенхимального типа в амебоидную клетку за счет уменьшения участка фокальной адгезии. [9] Изменение участка фокальной адгезии важно, так как участки фокальной адгезии имеют решающее значение для создания сборки актиновых стрессовых волокон и миграционного поведения клеток. [9] Изменение из клетки мезенхимального типа в клетку амебоидного типа обеспечивает более высокую скорость инвазии через коллаген. В клетках мезенхимального типа они зависят от фокальной точки адгезии и интегрина. Это позволяет им проникать через коллаген. Клетки амебоидного типа лишены стрессовых волокон и используют высокое сокращение, опосредованное миозином II, что позволяет им проникать в механизм блеббинга. [9] Этот процесс ученые изучают дальше, поскольку он может прояснить значительный рост инвазии и метастазирования, наблюдаемый при прохождении через плотную строму опухолей. [9] Мутации в ACTN4 могут вызывать заболевание почек фокальный сегментарный гломерулосклероз (ФСГС). [13]
Смотрите также
Ссылки
- ^ abcdefghijk Sjöblom B, Salmazo A, Djinović-Carugo K (сентябрь 2008 г.). «Структура и регуляция альфа-актинина». Cellular and Molecular Life Sciences . 65 (17): 2688–2701. doi :10.1007/s00018-008-8080-8. PMC 11131806 . PMID 18488141. S2CID 26321210.
- ^ Broderick MJ, Winder SJ (январь 2005). "Спектрин, альфа-актинин и дистрофин". Достижения в области белковой химии . Фибриллярные белки: спиральные спирали, коллаген и эластомеры. 70. Academic Press: 203–246. doi :10.1016/S0065-3233(05)70007-3. ISBN 9780120342709. PMID 15837517 . Получено 2023-11-06 .
- ^ abc Viel A (ноябрь 1999). «Структуры альфа-актинина и спектрина: разворачивающаяся семейная история». FEBS Letters . 460 (3): 391–394. doi :10.1016/S0014-5793(99)01372-1. PMID 10556504. S2CID 20832269.
- ^ Аб Сюй КС, Као HY (2013). «Альфа-актинин 4 и онкогенез рака молочной железы». Витамины и гормоны . 93 : 323–351. дои : 10.1016/B978-0-12-416673-8.00005-8. ISBN 9780124166738. PMC 4143506 . PMID 23810014.
- ^ Обзор медицинской физиологии Ганонга, 24-е издание . Ланге (Tata McGraw Hill). 2012. стр. 100.
- ^ Gabella G (6 декабря 2012 г.). «Структура гладких мышц». В Szekeres L, Papp JG (ред.). Фармакология гладких мышц . Springer Science & Business Media. стр. 17–18. ISBN 978-3-642-78920-5.
- ^ ab Рибейро Э., Пиноцис Н., Гислени А., Салмазо А., Конарев П.В., Костан Дж. и др. (декабрь 2014 г.). «Структура и регуляция мышечного α-актинина человека». Клетка . 159 (6): 1447–1460. дои : 10.1016/j.cell.2014.10.056. ПМЦ 4259493 . ПМИД 25433700.
- ^ abc Blanchard A, Ohanian V, Critchley D (август 1989). «Структура и функция альфа-актинина». Journal of Muscle Research and Cell Motility . 10 (4): 280–289. doi :10.1007/BF01758424. PMID 2671039. S2CID 22230767.
- ^ abcdef Thomas DG, Robinson DN (ноябрь 2017 г.). «Пятое чувство: механосенсорная регуляция альфа-актинина-4 и ее значение для метастазирования рака». Семинары по клеточной и эволюционной биологии . Механосенсорика: от молекул к тканям. 71 : 68–74. doi :10.1016/j.semcdb.2017.05.024. PMC 5659936 . PMID 28579451.
- ^ abcd Berman Y, North KN (август 2010). «Ген скорости: новая роль альфа-актинина-3 в мышечном метаболизме». Физиология . 25 (4): 250–259. doi :10.1152/physiol.00008.2010. PMID 20699471.
- ^ ab MacArthur DG, North KN (июль 2004 г.). «Ген скорости? Эволюция и функция альфа-актинина-3». BioEssays . 26 (7): 786–795. doi :10.1002/bies.20061. PMID 15221860. S2CID 19761762.
- ^ ab Lee FX, Houweling PJ, North KN, Quinlan KG (апрель 2016 г.). «Как дефицит α-актинина-3 изменяет мышечную функцию? Механистическое понимание ACTN3, «гена скорости»". Biochimica et Biophysical Acta (BBA) - Molecular Cell Research . 1863 (4): 686–693. doi : 10.1016/j.bbamcr.2016.01.013. PMID 26802899.
- ^ Polu KR, Pollack MR (25 февраля 2009 г.). «Фокальный сегментарный гломерулосклероз». В Lifton RP, Somlo S, Giebisch GH, Seldin DW (ред.). Генетические заболевания почек . Academic Press. стр. 117–118. ISBN 978-0-08-092427-4.
Внешние ссылки
- Актинин в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)