АТФ-связывающий мотив

Мотив связывания АТФ представляет собой последовательность из 250 остатков в первичной структуре белка, связывающего АТФ . Мотив связывания связан со структурой и/или функцией белка. [1] АТФ представляет собой молекулу энергии и может быть коферментом, участвующим в ряде биологических реакций. АТФ способен взаимодействовать с другими молекулами через сайт связывания. Сайт связывания АТФ представляет собой среду, в которой АТФ каталитически активирует фермент и , в результате, гидролизуется до АДФ. [2] Связывание АТФ вызывает конформационное изменение фермента, с которым он взаимодействует. [3]
Генетическое и функциональное сходство такого мотива демонстрирует микроэволюцию : белки заимствовали ту же самую последовательность связывания из других ферментов, а не разрабатывали их независимо. [4]
Участки связывания АТФ, которые могут быть репрезентативными для мотива связывания АТФ, присутствуют во многих белках, которым требуется поступление энергии (от АТФ), таких как активные мембранные транспортеры , субъединицы микротрубочек , белки жгутиков и различные гидролитические и протеолитические ферменты. [5]
Первичная последовательность
Короткие мотивы, включающие связывание АТФ, — это мотивы Уокера , Уокера А, также известные как P-петля, и Уокера В, а также мотив С и мотив-переключатель. [6]
Мотив Уокера А
Сайт Walker A имеет первичную аминокислотную последовательность GxxGxGKS или GxxGxGKT . Буква x может представлять любую аминокислоту. [7]
Мотив Уокера Б.
Первичная аминокислотная последовательность сайта Walker B — hhhhD , где h представляет любую гидрофобную аминокислоту. [7]
мотив C
Мотив C, также известный как сигнатурный мотив, мотив LSGGQ или линкерный пептид, имеет первичную аминокислотную последовательность LSGGQQ/R/KQR . [8] [9]
Из-за разнообразия различных аминокислот, которые могут быть использованы в первичной последовательности , как сайта Walker A, так и B, невариантные аминокислоты в последовательности являются высококонсервативными . Мутация любой из этих аминокислот повлияет на связывание АТФ или нарушит каталитическую активность фермента. [7] Первичная аминокислотная последовательность определяет трехмерную структуру каждого мотива. [3]
Структура
Все домены связывания АТФ состоят из приблизительно 250 остатков и двух субъединиц, образующих димер . Эти остатки свернуты в шесть α-спиралей и пять β-нитей. [7] [9]
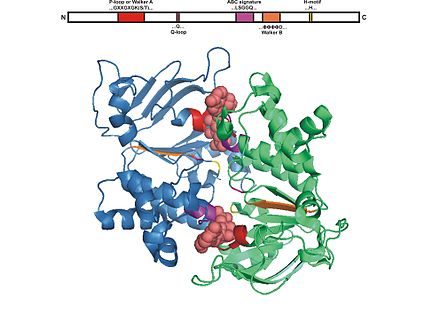
Мотив Уокера А
Структурно мотив Уокера А состоит из α-спирали , за которой всегда следует богатая глицином петля. [7]
Мотив Уокера Б.
Мотив Walker B представляет собой β-цепь . Мотивы Walker связаны друг с другом пептидной последовательностью из примерно 100 остатков. Структурно эти соединительные остатки складываются в α-спиральный домен. [7]
мотив C
Сразу за мотивом Уокера Б следует фирменный мотив. [7]
Мотив переключения
Было обнаружено, что мотив переключения расположен в конце β4-цепи в АТФ-связывающих белках. [7]
Функция
Каждый мотив связывания АТФ играет свою роль, независимо от того, участвует ли он напрямую в связывании АТФ или помогает в построении транспортера кассеты связывания АТФ (ABC) . [6] Молекула АТФ связывается с точкой соединения каждой субъединицы димера, указывая на то, что АТФ находится в непосредственной близости от обеих субъединиц во время катализа. Два мотива связывания, с которыми напрямую взаимодействует АТФ, — это остатки мотива Walker A, расположенные на одной из субъединиц, и остатки мотива связывания C, расположенные на другой субъединице. Мотив связывания Walker A имеет боковую цепь лизина , которая необходима для связывания АТФ. Остаток лизина образует водородные связи с атомами кислорода двух фосфатных групп в АТФ, тем самым создавая близость и ориентацию АТФ в месте связывания. [9] [7]
Для того чтобы мотив Walker A связался с АТФ, молекула АТФ должна находиться в месте связывания. Сигнатурный мотив действует как сигнал для мотива Walker A, давая Walker A знать, когда молекула АТФ связалась с местом связывания. Сигнатурный мотив делает это, позволяя своим остаткам простираться от субъединицы, в которой они расположены, в другую субъединицу, где находится мотив Walker A. Необходимо, чтобы АТФ связался с обоими доменами связывания нуклеотидов, чтобы завершить каталитически активную структуру. [9]
Мотив Walker B содержит аминокислоту глутамат в короткой последовательности. Глутамат может быть использован для выполнения нуклеофильной атаки на молекулу АТФ. [6]
В мотиве связывания переключателя обнаружен остаток гистидина . Функция гистидина заключается в каталитическом влиянии на реакцию путем контакта с остатками через интерфейс димера, включая мотив Walker A и мотив Walker B. Именно остаток гистидина образует прочную связь между связыванием молекулы АТФ и димером. [6] [9]
После гидролиза АДФ должно произойти конформационное изменение для разделения АТФ-связывающей кассеты. Это разделение обусловлено электростатическим отталкиванием продукта АДФ, который связан с мотивом Уокера А, а неорганический фосфатный продукт связан с мотивом С. [10]
Ссылки
- ^ Лю, Цзиньфэн; Рост, Буркхард (2003-02-01). «Домены, мотивы и кластеры во вселенной белков». Current Opinion in Chemical Biology . 7 (1): 5– 11. doi :10.1016/s1367-5931(02)00003-0. ISSN 1367-5931. PMID 12547420.
- ^ Чаухан, Джагат С.; Мишра, Нитиш К.; Рагхава, Гаджендра ПС (2009-12-19). «Идентификация остатков связывания АТФ белка из его первичной последовательности». BMC Bioinformatics . 10 : 434. doi : 10.1186/1471-2105-10-434 . ISSN 1471-2105. PMC 2803200. PMID 20021687 .
- ^ ab G., Voet, Judith; W., Pratt, Charlotte (29 февраля 2016 г.). Основы биохимии: жизнь на молекулярном уровне . John Wiley & Sons. ISBN 9781118918432. OCLC 910538334.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Чэнь, Де-Хуа; Чанг, Эндрю Ин-Фэй; Ляо, Бэн-Ян; Йен, Чэнь-Сян (2017-03-25). "Функциональная характеристика последовательностей мотивов при очищающем отборе". Nucleic Acids Research . 41 (4): 2105– 2120. doi :10.1093/nar/gks1456. ISSN 0305-1048. PMC 3575792. PMID 23303791 .
- ^ Риз, Дуглас К.; Джонсон, Эрик; Левинсон, Одед (2017-03-25). «ABC-транспортеры: сила изменений». Nature Reviews Molecular Cell Biology . 10 (3): 218– 227. doi :10.1038/nrm2646. ISSN 1471-0072. PMC 2830722. PMID 19234479 .
- ^ abcd Холленстейн, Каспар; Доусон, Роджер Дж. П.; Лохер, Каспар П. (2007-08-01). «Структура и механизм белков-транспортеров ABC». Current Opinion in Structural Biology . 17 (4): 412– 418. doi :10.1016/j.sbi.2007.07.003. ISSN 0959-440X. PMID 17723295.
- ^ abcdefghi Шнайдер, Эрвин; Ханке, Сабина (1998-04-01). "Системы транспорта кассеты связывания АТФ (ABC): функциональные и структурные аспекты субъединиц/доменов гидролиза АТФ". FEMS Microbiology Reviews . 22 (1): 1– 20. doi : 10.1111/j.1574-6976.1998.tb00358.x . ISSN 0168-6445. PMID 9640644.
- ^ Кумар, Антреш; Шукла, Сунит; Мандал, Аджит; Шукла, Судханшу; Амбудкар, Суреш В.; Прасад, Раджендра (2017-03-07). «Расходящиеся сигнатурные мотивы доменов связывания нуклеотидов мультилекарственного транспортера ABC, CaCdr1p патогенного Candida albicans, функционально асимметричны и не взаимозаменяемы». Biochimica et Biophysica Acta (BBA) - Биомембраны . 1798 (9): 1757– 1766. doi :10.1016/j.bbamem.2010.05.017. ISSN 0006-3002. PMC 2917344. PMID 20546701 .
- ^ abcde Дэвидсон, Эми Л.; Дасса, Эли; Орель, Седрик; Чен, Цзюэ (2008-06-01). «Структура, функция и эволюция бактериальных кассетных систем связывания АТФ». Обзоры микробиологии и молекулярной биологии . 72 (2): 317– 364. doi :10.1128/MMBR.00031-07. ISSN 1092-2172. PMC 2415747. PMID 18535149 .
- ^ Смит, Пол К.; Карпович, Натан; Миллен, Линда; Муди, Джонатан Э.; Розен, Джейн; Томас, Филип Дж.; Хант, Джон Ф. (2017-03-25). «Связывание АТФ с моторным доменом из транспортера ABC приводит к образованию димера сэндвича нуклеотидов». Molecular Cell . 10 (1): 139– 149. doi :10.1016/S1097-2765(02)00576-2. ISSN 1097-2765. PMC 3516284 . PMID 12150914.